合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(一)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(四)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(三)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(二)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(一)
> 弱堿三元采出液油水界面動態界面張力、強度、等特性研究
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(二)
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(一)
> 無人機噴霧作業下荔枝葉片上的表面張力、接觸角及霧滴沉積特性
> 不同界面張力-潤濕性組合的滲吸液體系對于化學滲吸效果的影響規律
溶出試驗中使用表面活性劑時注意事項
來源:藥渡經緯 瀏覽 873 次 發布時間:2022-09-20
在難溶性藥物的溶出方法開發過程中,有時會使用到表面活性劑來提高藥物的溶出,這其中可能會遇到很多“有趣”的問題,本文進行了簡要分析,供廣大研發人員討論。
1、加入表面活性劑前應做哪些研究?
通常情況下,如果藥典中的常規介質(如pH1.0-3.0鹽酸溶液、pH4.0或4.5醋酸鹽緩沖液、pH6.8磷酸鹽緩沖液、水)能夠使難溶性藥物完全溶出,則不必考慮在溶出介質中加入表面活性劑。對于一些不能通過常規介質測定的難溶性藥物,選擇加入表面活性劑往往是“最后的選擇”。加入表面活性劑雖然能夠提高溶出,但有時可能會“掩蓋”制劑的某些性能,極有可能出現體外溶出曲線相似,體內不等效的情況,因此無論有無可以參考的質量標準或溶出條件,表面活性劑的使用都應該進行詳細評估,不能直接套用已有方法中的種類或濃度。
通常在確定要加入表面活性劑之前,應進行以下研究,證明制劑在截止時間內,藥物在所有溶出介質中平均溶出量均達不到85%,如果有一種溶出介質達到85%以上則可以不必考慮使用表面活性劑。
(1)不含表面活性劑的常規四種或多種介質中的溶出曲線考察(0%濃度)。此時可以根據情況選擇900ml或1000ml體積,在常規低轉速下,如50rpm(槳法)或100籃法下進行研究,繪制自制制劑和/或參比制劑溶出曲線。
(2)提高轉速(常用)。如75rpm、100rpm、150rpm等,根據USP規定,超過150rpm的轉速不推薦使用。
(3)增加采集時間,考察是否達到平臺。此法比較耗時,通常確定截止時間最長為60min-120min。
(4)根據藥物性質,有時可考察不同離子強度,不同鹽種類的影響。
此外,還應測定藥物的pH-溶解度曲線,結合以上結果確定在何種溶出量較低的介質中加入表面活性劑。
2、使用表面活性劑時應進行哪些研究?
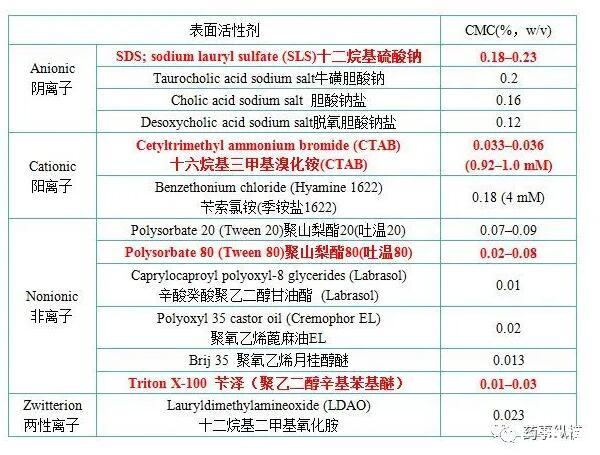
如果上述條件都不合適,可以考慮采用加入表面活性劑,此時應查詢國內外文獻、專利、質量標準,并結合藥物結構選擇表面活性劑的種類。篩選時,應根據情況考慮涵蓋所有常用種類的表面活性劑,比如陰離子型、陽離子型、和非離子型。USP中列舉了多種商品化的表面活性劑及其臨界膠束濃度(Critical Micelle Concentration,CMC)的近似臨界值,在方法開發中可以參考。
常見表面活性劑的種類及臨界膠束濃度
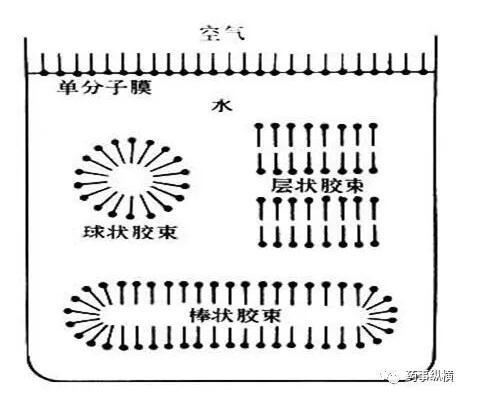
膠束的概念由Mcbain在1925年首次提出,認為當濃度升至一定值時,表面活性劑分子在水溶液中從單體締合為“膠態聚集態”,并稱之為“膠束”,所形成的這些膠束是熱力學穩定的,從而將形成膠束時的濃度稱之為臨界膠束濃度,簡稱CMC。
一般認為,在表面活性劑濃度不大時,沒有其他添加劑的溶液中膠束大多呈球狀,在十倍于CMC或更濃的溶液中,膠束一般為非球狀,如棒狀;隨著溶液濃度的不斷增加,棒狀膠束聚集呈束狀,濃度更大時形成層狀。
含有表面活性劑溶液中一旦形成了膠束后,溶液的一系列化學性質將會會發生改變,例如表面張力、滲透壓、潤濕、增溶、乳化、起泡等。CMC受無機鹽、有機添加劑和氫離子濃度的影響。
USP表中所列表面活性劑并不全面,不能排除未列出的表面活性劑。其他表面活性劑,如羥丙基β-環糊精,已被用來作為溶出介質添加劑提高難溶性化合物的溶解度。在這些表面活性劑中最常用有CTAB、SDS、吐溫80和Triton X-100。
根據USP規定,一般情況下,表面活性劑的濃度應高于它的CM,但在實際工作中往往低于CMC濃度或在其范圍內的情況也能夠使溶出符合要求,因此USP的規定并不代表一定要高于CMC濃度,應具體問題具體分析。
不同級別(或純度)的表面活性劑會影響藥物的溶解度,因此要對表面活性劑的級別和純度進行詳細的對比研究和必要的控制,例如,SDS應使用高純度級并固定廠家來源。吐溫80的純度和來源影響外觀(顏色)及其中的雜質含量,在使用HPLC方法進行分析時,不同來源的吐溫80往往會表現出不同的雜質行為,對色譜柱及色譜條件要求較高。此外,反離子或pH值可能會影響表面活性劑溶液的溶解性或穩定性,例如,當含有SDS的磷酸鹽緩沖液中鉀鹽濃度為0.5mol/L時,就會形成沉淀析出,但是使用其鈉鹽制備含有SDS的介質時,就可以避免這種現象發生。
關于表面活性劑的使用量,在《普通口服固體制劑溶出曲線測定與比較指導原則》中規定:表面活性劑濃度推薦在0.01%-1.0%(W/V)范圍內依次遞增考察,特殊品種可適度增加濃度。說明表面活性劑通常考察在0.01%-1.0%之間,必要時可以考慮超過上述濃度,此時應有研究說明。
日本《仿制藥生物等效性試驗指導原則2012版》中規定:吐溫-80的濃度應從0.01%、0.1%、0.5%和1.0%(W/V)依次遞增。增加時,只要pH1.2、pH4.0和pH6.8任何一個介質中,參比制劑在規定的時間內平均溶出率達85%以上,則設定該介質中的吐溫-80濃度作為溶出度試驗用最低濃度。如果遞增至最高濃度,參比制劑在規定時間內平均溶出率仍達不到85%,則設定溶出速率最快介質中的吐溫-80濃度作為溶出度試驗用濃度。如果吐溫-80與藥物本身或添加劑反應,影響藥物的溶出,則將緩沖溶液從磷酸二氫鈣換成磷酸二氫鈉,使用十二烷基硫酸鈉亦可。但使用十二烷基硫酸鈉的藥物溶解度,不能超過吐溫-80最大濃度的溶解度。
USP等國外藥典標準或FDA溶出數據庫中公開的含有表面活性劑的溶出介質一般都含有較高的濃度,往往不具有區分力,需要降低濃度進行對比研究。進行不同種類的表面活性劑的不同濃度篩選時,可以使用6杯或12杯溶出儀進行篩選,如每種介質平行做2片參比制劑(或仿制制劑),一次可以做3或6種,或者不同濃度的對比試驗。目標是確定使藥物在合適時間(如60-120min)達到85%以上所需要的最低量。表面活性劑逐漸增加的濃度也常見0%、0.1%、0.25%、0.5%、0.75%、1.0%、2.0%情況,研究時宜逐級進行考察。
3、使用表面活性劑時的案例分析
表面活性劑的種類、濃度、來源、純度、級別、與介質中添加劑的相容性問題是常規考察項,必須進行研究。除此之外,表面活性劑與藥物本身的相互作用情況也不容忽視。
案例1:藥物與SDS發生相互作用
藥物離子與表面活性劑之間的離子對相互作用在溶出介質中經常發生,可導致藥物溶出不完全。本例中堿性藥物B(pKa為4.9、5.6)在pH4.5以下溶解度很高,沒有區分力,因此考察4.5以上的溶出情況,而由于在此范圍內溶解度又很低,因此考慮加入SDS進行考察。
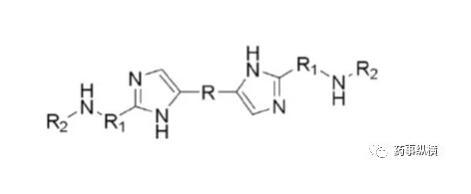
藥物B的化學結構
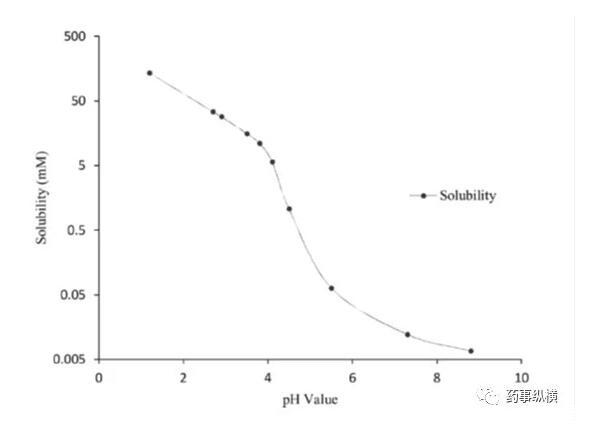
藥物B的pH-溶解度曲線
研究中發現,在含有低于CMC濃度的SDS的pH4.5介質中形成了不溶性鹽,影響了藥物的溶解度和制劑的潤濕性,而在高pH時這種現象不明顯。pH4.5介質中,當SDS濃度高于CMC濃度時,其溶出也比不加SDS的情況慢。
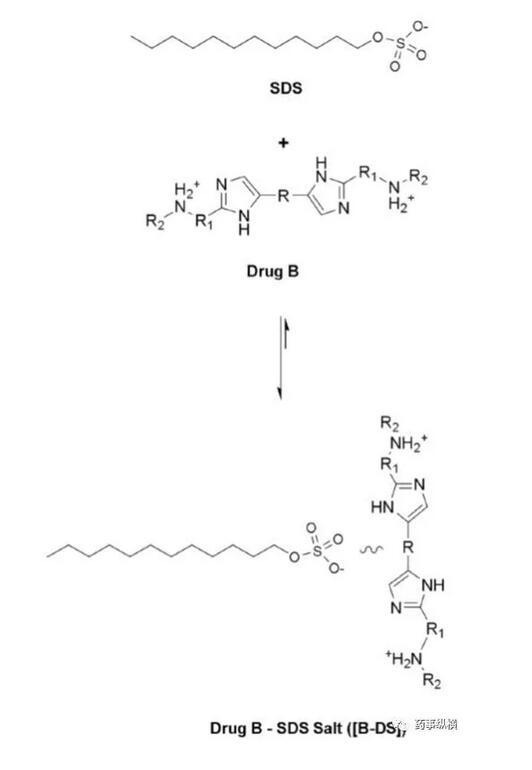
藥物B與SDS成鹽示意圖
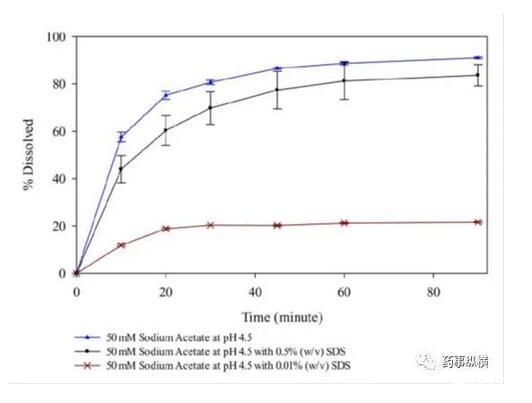
含不同濃度SDS的pH4.5介質溶出曲線
藥物B在不同SDS濃度pH4.5、pH5.5、pH6.8介質中的溶解度
根據上述研究,最后選擇了非離子表面活性劑。本例說明在對離子型藥物進行溶出研究時,應考慮到藥物與離子型表面活性劑的相容性,相容性與介質pH環境、緩沖液種類、離子強度等有關。
本例藥物B在pH4.5介質中的溶出低是由于介質中加入SDS形成難溶性鹽引起的,這種情況在體內可能是并不存在的,也許藥物B已經滿足BE了。因此,對于堿性藥物,需要注意介質中加入SDS后可能導致錯誤的判斷。
案例2:表面活性劑溶液增加了藥物的穩定性
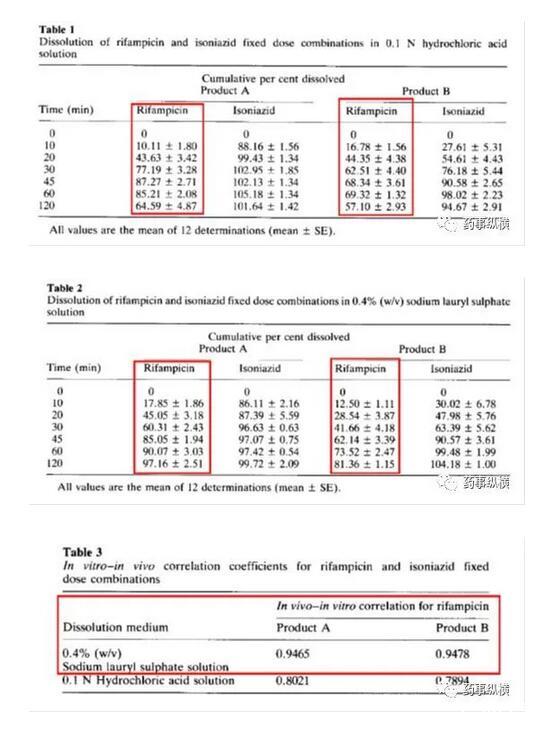
利福平與異煙肼復方制劑在進行溶出曲線測定時發現利福平在0.1N鹽酸中不穩定,發生降解。由于利福平在水中不溶,因此采用了0.4%SDS溶液進行了研究,結果表明在整個分析檢測過程中無降解。而且,0.4%SDS溶液的體內外相關性很好。
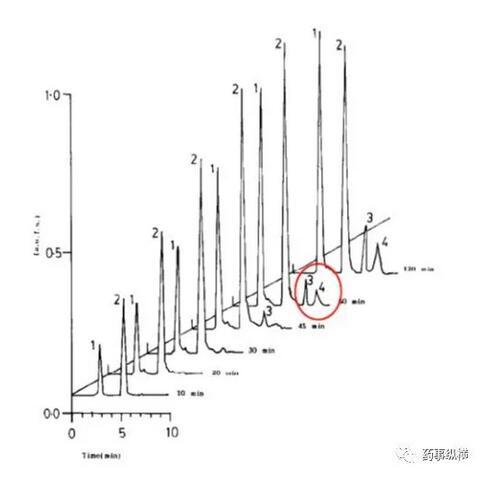
利福平在酸溶液中的降解情況(3、4為兩個降解物峰)
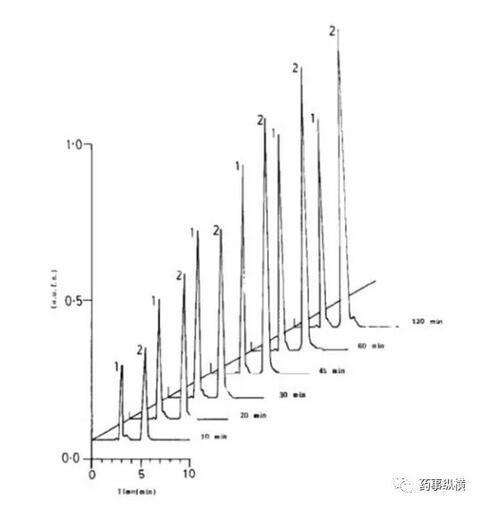
利福平在0.4%SDS溶液中的情況(無3、4兩個降解物峰)
通過總結可知,表面活性劑在溶出過程中可能涉及如下作用:降低溶出介質表面張力、增加制劑潤濕性促進了藥物溶出;與藥物不相容(成鹽或促進降解),降低了藥物溶出;與介質不相容(如SDS與鉀鹽),形成沉淀;使藥物在表面活性劑溶液中更穩定等。其他類型的表面活性劑在使用時(如溶出或處方中用到),類似問題也需引起總結和思考。
參考文獻
1、USP:溶出度方法的開發與驗證
2、《普通口服固體制劑溶出曲線測定與比較指導原則》
3、《仿制藥生物等效性試驗指導原則2012版》
4、Zongyun Huang,Shuchi Parikh,William P.Fish.Interactions between a poorly soluble cationic drug and sodium dodecylsulfate in dissolution medium and their impact on in vitro dissolution behavior[J].International Journal of Pharmaceutics,535(2018)350–359
5、K.C.Jindal,R.S.Chaudhary,A.K.Singla,S.S.Gangwal,S.Khanna.Dissolution test method for rifampicin—isoniazid fixed dose formulations[J].Journal of Pharmaceutical and Biomedical Analysis,Volume 12,Issue 4,April 1994,Pages 493-497










