合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(一)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(四)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(三)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(二)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(一)
> 弱堿三元采出液油水界面動態界面張力、強度、等特性研究
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(二)
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(一)
> 無人機噴霧作業下荔枝葉片上的表面張力、接觸角及霧滴沉積特性
> 不同界面張力-潤濕性組合的滲吸液體系對于化學滲吸效果的影響規律
干細胞誘導的人小腸上皮模型用于藥物吸收的體外研究
來源:蘇州北科納米 瀏覽 643 次 發布時間:2022-09-16
小腸(hSI)是人類重要的器官,執行著包括消化在內的眾多功能,包括但不限于初始和選擇性屏障活動、營養吸收、宿主-微生物相互作用,以及宿主防御和免疫反應的調節。口服給藥是最常見的給藥方式,許多藥物在小腸中被吸收并開始代謝。過去十年,研究者嘗試總結體內腸道復雜生理功能的各個方面,并利用人類結腸腺癌細胞系(Caco-2)以及人工膜系統,來建立評估藥物在小腸中的吸收和代謝的實驗模型。然而,現有的模型無法充分模擬hSI的功能,也無法反映藥物轉運體、藥物代謝酶和緊密連接的表達模式所扮演的重要作用。此外,這些模型中缺乏細胞色素P450酶(CYP3A4),而hSI中最豐富的藥物代謝酶正是P450,這導致了Caco-2模型不適合研究腸道首過效應和生物利用度。近年來,原代人腸上皮細胞(hIEC)模型的發展取得了顯著進展,例如3D人體腸道類器官(hIOs)。但由于人體腸道類器官內缺乏增殖細胞群,難以將腸上皮細胞培養成融合的單分子層,因此從人體腸道類器官生成單層hSI模型十分困難。
鑒于此,韓國生命工學研究院的一項研究開發了一種重復性良好的兩步方法來誘導人多能干細胞分化為可擴大的hIEC祖細胞和具有功能性的hIEC單層細胞。

為了從人多功能干細胞(hPSCs)中獲得單層hSI模型,研究者建立了一種新的定向分化方案,來模擬體內腸道發育過程。該方案采用激活素A(Activin A)、表皮生長因子(EGF)、Wnt信號通路激動劑R-spondin 1和胰島素等來誘導hPSCs向hIEC祖細胞分化,并進一步分化為有功能性的hIEC。經過長時間傳代后(大于10代,培養大于5個月),腸細胞標記物和緊密連接分子的表達沒有明顯變化,腸上皮功能相關實驗同樣使用Transwell系統。
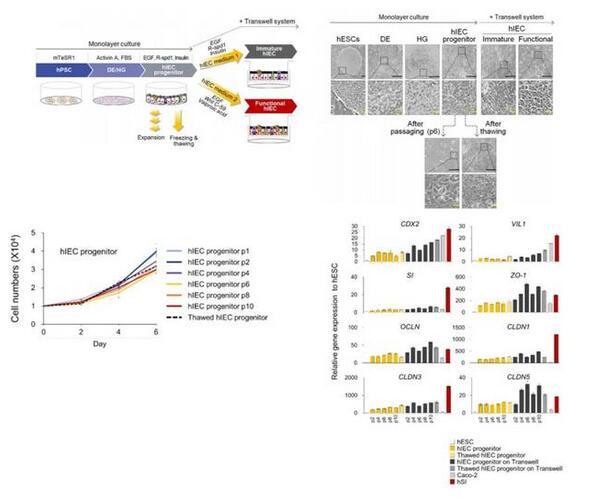
圖1|由hPSCs分化hIECs的過程與相關表征
由于在hSI中,Wnt的抑制和Notch的激活有助于祖細胞分化為吸收前上皮細胞,研究者使用了Wnt信號抑制劑Wnt-c59和Notch信號激動劑丙戊酸(VPA),來進一步將hIEC祖細胞分化為與體內類似的成熟且有功能的hIEC。與其他僅由吸收性腸細胞組成的小腸上皮模型相比,該系統可以模擬體內樣腸組織進行研究。與未成熟的hIECs相比,功能性hIECs形成了一個結構極化的單層,并觀察到了類似杯狀細胞分泌出的粘液。此外,功能性單分子層hIEC的頂表面接觸的細菌數量明顯更高,并且黏液蛋白和黏液蛋白相關基因的表達在功能性hIEC中顯著增加能夠允許腸道微生物群的持續定植。
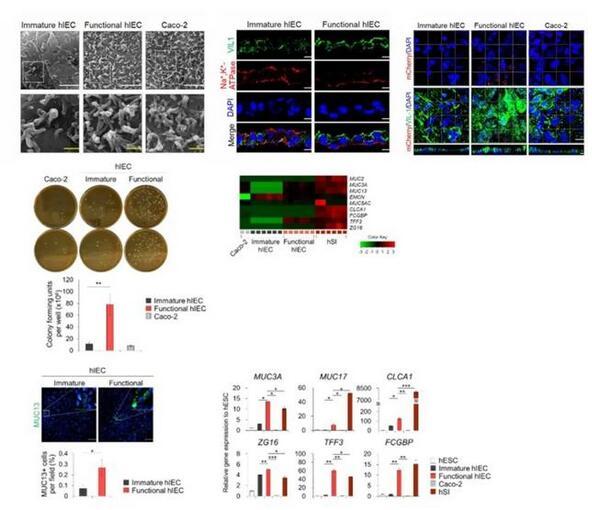
圖2|功能性hIECs單層模型的結構與功能表征
隨后,研究分析了各種腸道轉運體和代謝酶的表達水平,通過RNA測序與酶活性檢測,發現腸道堿性磷酸酶(IAP)和CYP3A4在功能性hIEC中表達量相當高,這些結果表明功能性hIEC具有藥物轉運體和藥物代謝酶活性,是評價藥物體外生物利用度所必需的。本研究使用了6種臨床藥物:美托洛爾、普萘洛爾、雙氯芬酸、雷尼替丁、呋塞米和紅霉素,進行體外藥物吸收試驗,發現與Caco-2模型不理想的體內外相關性相比,功能性hIEC與已公布的人體內腸道吸收數據擬合的相關性良好,說明功能性hIEC可以更好地預測人的口服生物利用度和吸收程度。
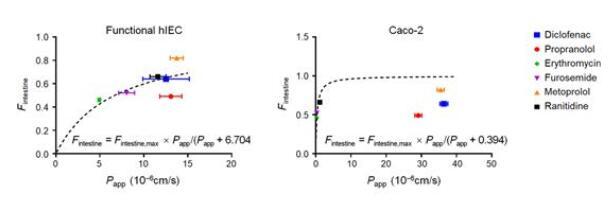
圖3|6種臨床模型藥物在功能性hIECs與Caco-2模型上吸收的擬合結果
總而言之,此研究發明了一套可靠且完善的hIECs培養系統,可以用來產生具有接近體內功能的小腸上皮單層,以取代目前的體外模型,提供一個新的通用的藥物體外腸吸收的檢測平臺。










