合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(一)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(四)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(三)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(二)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(一)
> 弱堿三元采出液油水界面動態界面張力、強度、等特性研究
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(二)
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(一)
> 無人機噴霧作業下荔枝葉片上的表面張力、接觸角及霧滴沉積特性
> 不同界面張力-潤濕性組合的滲吸液體系對于化學滲吸效果的影響規律
首次揭示溶酶體修復的核心機制,理解衰老更近一步
來源:轉化醫學網 瀏覽 790 次 發布時間:2022-09-13
導讀:近幾十年來,已有諸多研究發現了溶酶體的重要功能——參與細胞免疫、營養感知、清除受損細胞組分、降解生物大分子等諸多細胞活動。因此,溶酶體本身的損傷及活性下降,在衰老和疾病中扮演著重要角色;但一直以來鮮有研究對溶酶體的修復機制進行深入探索。近日,科學家們首次揭示了溶酶體修復的核心機制——該機制將引領人們進一步探索眾多與衰老相關的疾病,尤其是包括阿爾茨海默病在內的神經退性疾病。
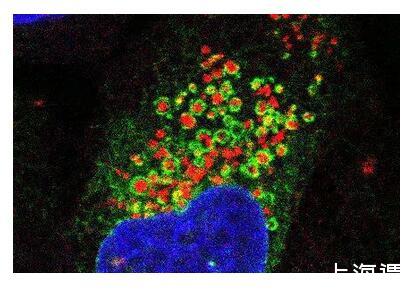
9月7日,來自匹茲堡大學醫學院細胞生物學系的譚小軍博士與衰老研究所所長Toren Finkel博士在《自然》(Nature)雜志發表了一篇題為“A phosphoinositide signalling pathway mediates rapid lysosomal repair”的細胞生物學領域研究論文。研究者們通過一系列實驗,首次描述了一種溶酶體修復的核心途徑:PITT途徑(phosphoinositide-initiated membrane tethering and lipid transport)。通過該途徑,細胞能快速修復已受損的溶酶體。該發現將協助人們進一步了解和治療由溶酶體受損驅動的與年齡相關的疾病。

https://www.nature.com/articles/s41586-022-05164-4
細胞的“自殺口袋”——溶酶體
01
20世紀50年代,現代細胞生物學創始人之一、諾貝爾生理學或醫學獎得主Christian de Duve教授首次發現了動物細胞中的“溶酶體”(lysosomes),并且一度稱之為細胞的“自殺口袋”:這種細胞器含有大量水解酶,可降解細胞內的蛋白質等生物大分子;由此可能在細胞自殺過程中發揮作用。隨著近幾十年來對溶酶體的進一步探索,人們已發現溶酶體的諸多其他重要功能——例如,參與細胞免疫、營養感知、清除受損細胞組分等細胞活動。由此,溶酶體自身的損傷及活性下降,在細胞衰老、人類疾病中扮演著至關重要的角色。
該研究論文的第一作者、來自匹茲堡大學醫學院的譚小軍博士表示:“溶酶體損傷是包括衰老在內的許多疾病的標志,尤其像阿爾茨海默病等神經退行性疾病。探索、理解溶酶體修復的核心機制,將幫助我們進一步研究正常衰老、與衰老相關的疾病。”
溶酶體修復核心機制——PITT途徑
02
之前的研究普遍認為,細胞中存在兩種潛在的溶酶體修復機制——溶酶體自噬(lysophagy)介導的間接修復;以及內體分選復合物(ESCRT)介導的直接膜孔修復。然而,科學家發現,在缺乏上述兩種機制的情況下,溶酶體損傷仍然能夠被快速修復;這不禁讓人猜測,細胞中還存在更重要的修復途徑來治愈溶酶體損傷。
首先,研究者用生物素對溶酶體表面的所有蛋白進行了標記,然后通過組學方法來尋找溶酶體受損后,表面特異性富集的蛋白。此研究發現,溶酶體一旦受損,在短短幾分鐘后,一種叫PI4K2A的激酶就會到達現場,隨后導致脂質信號PI4P(磷脂酰肌醇4-磷酸)大量富集于溶酶體表面。
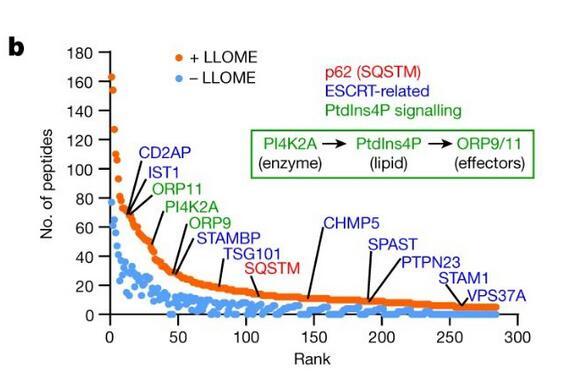
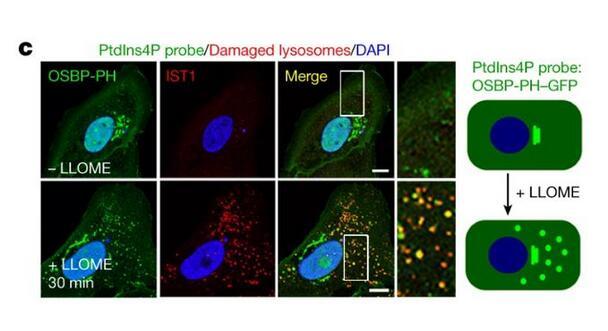
蛋白組學揭示受損溶酶體表面的PI4P信號:
b.蛋白組學分析溶酶體表面蛋白;
c.受損溶酶體PI4P信號示意圖。
PI4P信號觸發了“警報系統”,有選擇性地對受損溶酶體進行標記。這將進一步招募ORP家族蛋白(包括ORP9/10/11和OSBP)——它們一端結合受損溶酶體上的PI4P,另一端結合在內質網上。內質網是細胞中最大的膜結構細胞器,負責脂質與蛋白質的合成。在ORP家族蛋白的幫助下,內質網與受損溶酶體緊密地結合起來。
在一般的情況下,內質網和溶酶體幾乎不會接觸,或者僅有十分短暫的局部接觸;但此研究發現,一旦溶酶體受損,內質網和溶酶體就會“相互擁抱”。譚小軍博士表示,這可能是目前觀察到的最強的細胞器間互作。
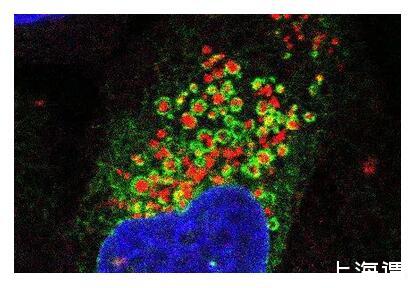
熒光顯微圖像顯示了內質網(綠色)像毯子一樣包裹住受損的溶酶體(紅色),細胞核以藍色顯示。
通過這種“擁抱”,ORP家族蛋白作為脂質轉運體,繼而將膽固醇和一種叫做磷脂酰絲氨酸(PS)的脂質從內質網運送到溶酶體,以促進溶酶體膜的修復。研究者發現,只要溶酶體上能富集膽固醇和PS中的一種,受損溶酶體就能得到快速修復。膽固醇含量上升可以提高細胞膜的穩定性,這可能預示膽固醇或許直接參與溶酶體修復。然而,PS并沒有已知的提高生物膜穩定性的功能。為了破解PS如何介導溶酶體修復,研究者們將目光投向了一系列可能被PS激活的大規模脂質轉運蛋白。
他們發現,溶酶體上的PS激活了一種被稱為ATG2的脂質轉運蛋白。ATG2就像一座橋梁,將大量脂質運送到溶酶體,直接修復溶酶體膜,在新發現的這一修復途徑中完成最后一步。
研究者表示:“ATG2有一個經典的功能,即轉運脂質介導自噬體的形成。自噬和溶酶體修復都依賴于ATG2的脂質轉運功能,但兩個過程相互獨立,互不影響。”通過在溶酶體表面過表達ATG2的一個片段,研究人員選擇性地阻斷了內源性ATG2介導的溶酶體修復,發現ATG2在自噬中的作用并未受此影響。
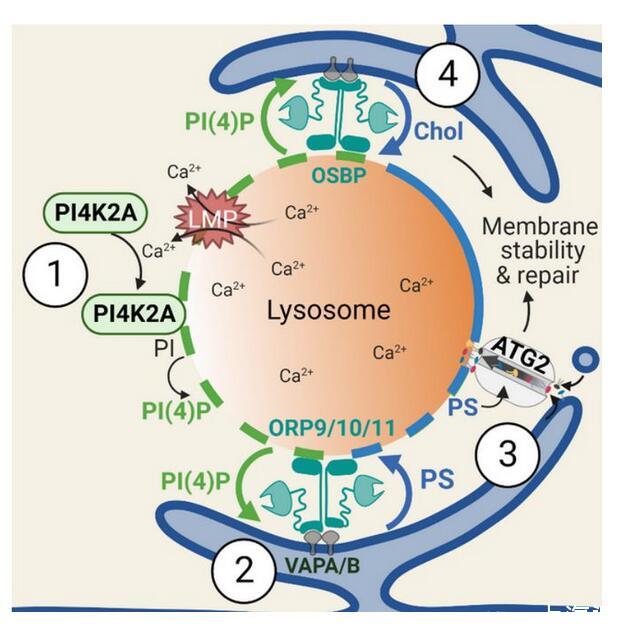
細胞快速修復溶酶體損傷的統一核心機制:PITT途徑
對理解衰老、衰老相關疾病的意義
03
綜上,此研究發現了細胞快速修復溶酶體損傷的核心機制——溶酶體損傷促發了溶酶體表面的一種特殊脂質信號PI4P;而這一信號推動了內質網和溶酶體間的強烈互作,進而激活內質網向溶酶體的多重脂質轉運。
Finkel博士說表示:“這個系統的美妙之處在于,PITT途徑的所有參與蛋白都是已知的分子,但過去并不知道它們會相互合作以及在溶酶體修復過程中發揮作用。這些發現將對理解正常衰老和與衰老相關的疾病產生重要意義。”
作者發現,多種不同機制導致的溶酶體損傷,都能激活PITT途徑。由此推測,在健康人體內,溶酶體膜的小破損會通過PITT途徑迅速得到修復。然而,當損傷過度時——由于衰老或疾病等因素導致修復途徑受阻,破損的溶酶體會積聚在細胞內導致二次傷害。
以阿爾茨海默病為例,tau纖維突破溶酶體膜繼而侵襲擴散是疾病進展的關鍵步驟。此研究通過實驗敲除了編碼PITT途徑中第一個酶PI4K2A的基因,發現tau纖維的侵襲擴散急劇增加,這表明PITT途徑的缺陷可能加速阿爾茨海默病的進程。
在未來,研究者計劃開發小鼠模型,以了解激活PITT途徑能否保護小鼠免于患上阿爾茨海默病的發展。
參考資料:
https://phys.org/news/2022-09-pitt-pathway-scientists-cells-longevity-promoting.html
http://k.sina.com.cn/article_5895622040_15f680d9802001dr6m.html?display=0&retcode=0
注:本文旨在介紹醫學研究進展,不能作為治療方案參考。如需獲得健康指導,請至正規醫院就診。










