合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(一)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(四)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(三)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(二)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(一)
> 弱堿三元采出液油水界面動態界面張力、強度、等特性研究
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(二)
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(一)
> 無人機噴霧作業下荔枝葉片上的表面張力、接觸角及霧滴沉積特性
> 不同界面張力-潤濕性組合的滲吸液體系對于化學滲吸效果的影響規律
為什么水與油互不相溶?
來源:老粥科普 瀏覽 1117 次 發布時間:2022-06-21
許多人都有這樣的經驗,在常溫狀態下,無論是你將油倒入水里,還是把水倒進油中,它們并不會互相融合成為某種稀釋的溶液,而是很快地分開,形成一個明顯的界面。這究竟是為什么呢?
有人說,這是因為油比水輕呀!所以油就浮在水的上面。這顯然站不住腳,因為酒精也比水輕,但它能與水完全溶合;同時盡管絕大多數的油密度低于水,但這卻不是二者互不相溶的真正原因。從科學的角度來看,兩種液體是否相溶與它們的比重無關,而與它們的分子極性密切相關。

利用水油分層制成的液體“沙漏”,有顏色的是水
分子之間的力
液體分子之間通常存在兩種相互作用力:范德華力和氫鍵,這兩種力使分子之間相互吸引又保持一定的距離,它們是由分子的化學電性質決定的。
我們知道分子內部各原子之間通常以共價鍵或離子鍵相結合,這是由原子之間電子的共享與交換引起的力,這種電磁力通常比較強、作用距離也很短,你要是想把一個分子拆開來需要消耗比較大的能量。
分子與分子之間的范德華力是弱化學力中最弱的一種,其強度在0.4~4kJ/mol之間。當兩個原子間距離大于0.6nm時,我們不足以觀察到范德華力;同樣,當原子間距離小于0.4nm時,力就會排斥。

壁虎是依靠范德華力在墻壁上爬行的
水由氫和氧原子組成。當氫(H)原子與氧(O)、氮(N)或氟(F)結合時,氫唯一的一個電子會與它們形成共價鍵,這時候氫原子的電子由于被O、N或F吸引而稍稍“跑偏”,導致氫原子這一端呈現更多的正電性(氫原子核帶正電);與之相對應地,分子的另一端會因為吸引電子的能力更強而顯示出負電。分子對外顯示出比較強的電極性,分子與分子之間會因為電極性的不同而相互吸引。
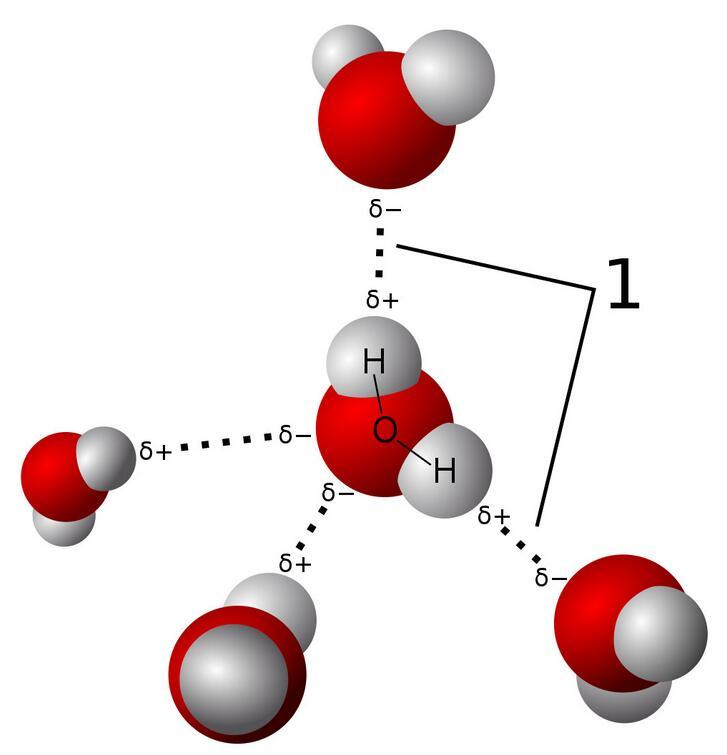
水分子間通過強大的氫鍵連接
氫鍵的極性很強,當分子之間通過氫鍵相互吸引時,它的能量通常比范德華力要大許多倍。這正是水相比于其它液體擁有多種獨特性質的原因。

氫鍵是水表面張力的重要原因
分子的極性
每一種原子的原子核吸引電子的能力都不相同,當這些原子通過共價鍵相互結合成分子時,電子的運動軌跡會更偏向于那些吸引力更強的原子,這就造成了分子擁有一定的極性。分子的極性是分子間相互作用力的重要因素之一。
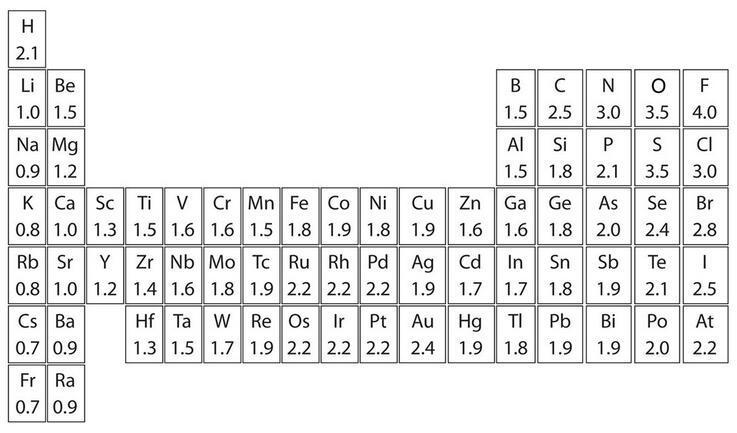
元素的電負性用來確定共價鍵的極性
上圖是元素周期表中部分元素電負性的標量,電負性是一個無單位數,數字越高,原子吸引電子的能力越強。我們可以通過確定參與共價鍵的兩個原子的電負性的差異來判斷共價鍵的極性:
當分子中兩個原子電負性的差異為0時,原子之間為非極性共價;
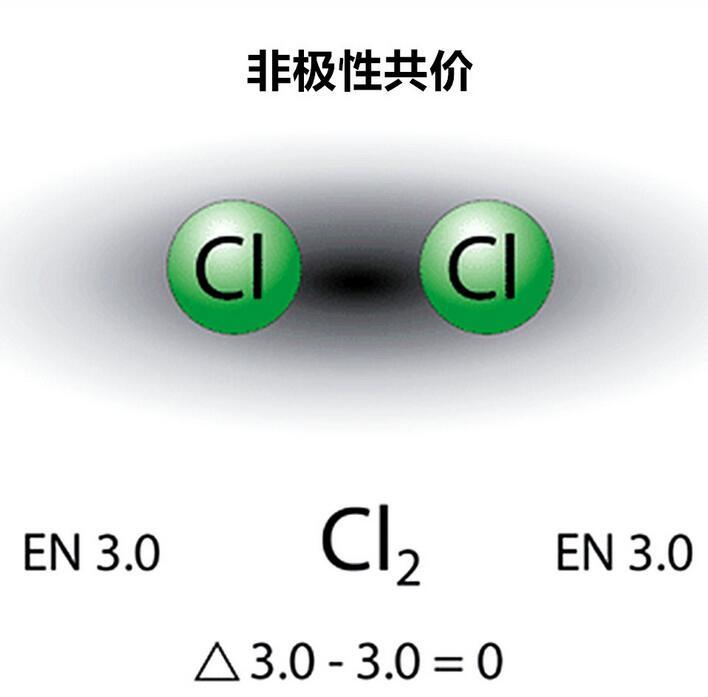
氯分子的非極性共價
當電負性差異的值為0~0.4之間,共價是弱極性的,分子對外依然顯示非極性的特征;
當電負性差異的值為0.5~2.0之間,原子間為絕對極性共價;
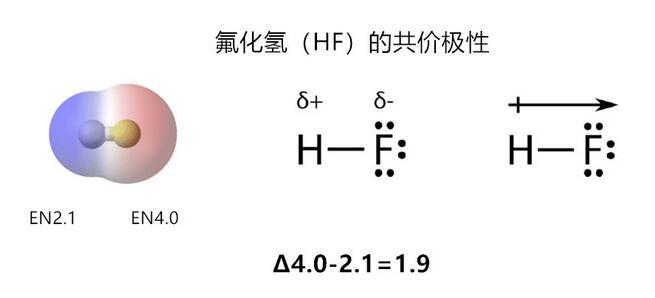
氟化氫分子有很強的極性
而當這個值>2.0時,原子之間就是離子鍵合而非共價鍵了。食鹽(NaCl)就是離子鍵,因為Na的電負性為0.9,而Cl的電負性是3.0,二者的差值3.0-0.9=2.1>2.0,因此食鹽很容易溶于水。
當兩個原子間由極性共價關系相結合時,分子的一端會稍稍顯示出正電荷,而另一端相應帶負電荷,這種分子有兩個相反的電“極”,因此我們稱之為偶極子。
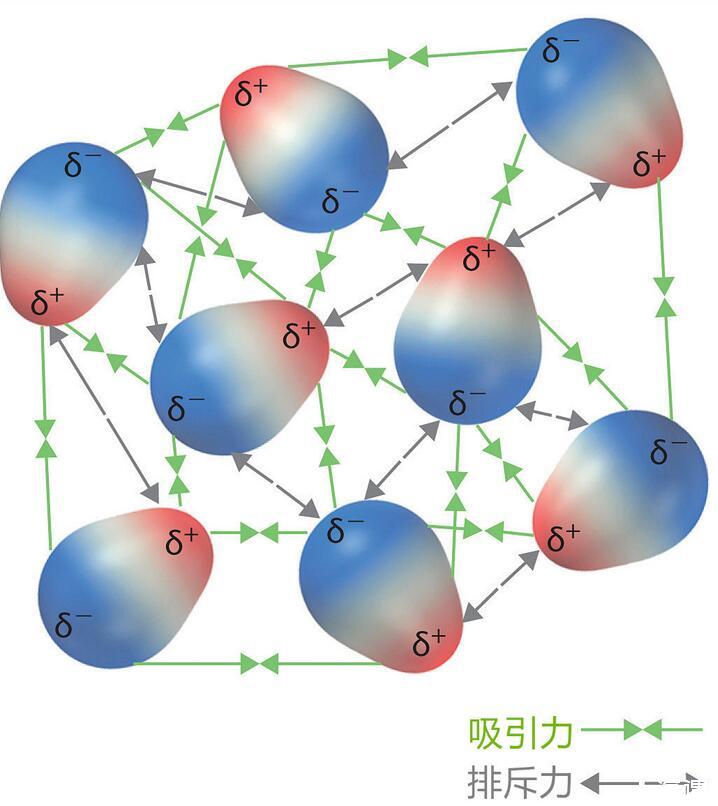
液體偶極子之間力的平衡關系
如果分子是由兩個以上原子組成,在確定分子是極性還是非極性時,還必須考慮分子的幾何形狀。下圖顯示了二氧化碳分子與水分子之間的比較,二氧化碳是線性分子,偶極子因強度相同方向相反而互相抵消,對外顯示整體分子的極性為零;水分子的兩個極性鍵有夾角,因此整體對外顯示出極性。
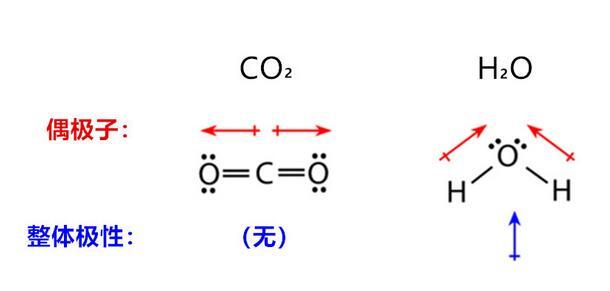
二氧化碳與水分子的極性
非極性分子間的力
非極性分子之間沒有強大的氫鍵結合,那么它們是如何相互影響的呢?
前節介紹了氯氣分子和二氧化碳分子,它們都是非極性的。對于由更多原子組成的一些分子,由于組合幾何結構的關系,它們也往往對外顯示出極性或非極性。比如三角形平面排列的三氟化硼和四面體排列的甲烷,它們都是非極性分子,因此不會產生整體偶極子。
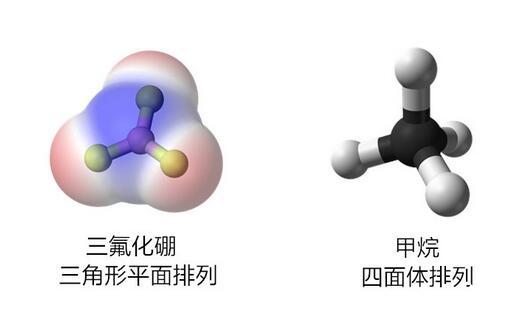
對稱排列不會產生整體偶極子
非極性分子是通過倫敦分散力進行結合的。倫敦分散力簡稱“倫敦力”,它是指非極性分子內部由于電子移動產生的瞬時偶極誘導的偶極力。倫敦力是范德華力的一部分,因此它并不與范德華力相矛盾。
非極性分子盡管整體上對外不顯示極性,但它內部電子在運動的過程中會因為移動位置的原因產生某些瞬間的不平衡,這種內部電荷的不平衡狀態反應到整個分子上,就使得分子在某些瞬間產生整體的偶極性。當一個分子出現瞬間極性時,它會感應附近的分子,使之電荷相反,從而實現互相吸引。由于倫敦力的相互吸引作用很弱,導致非極性分子的間距較大,油大多由非極性分子組成,因此油的密度普遍比水低,它會浮在水的上方。
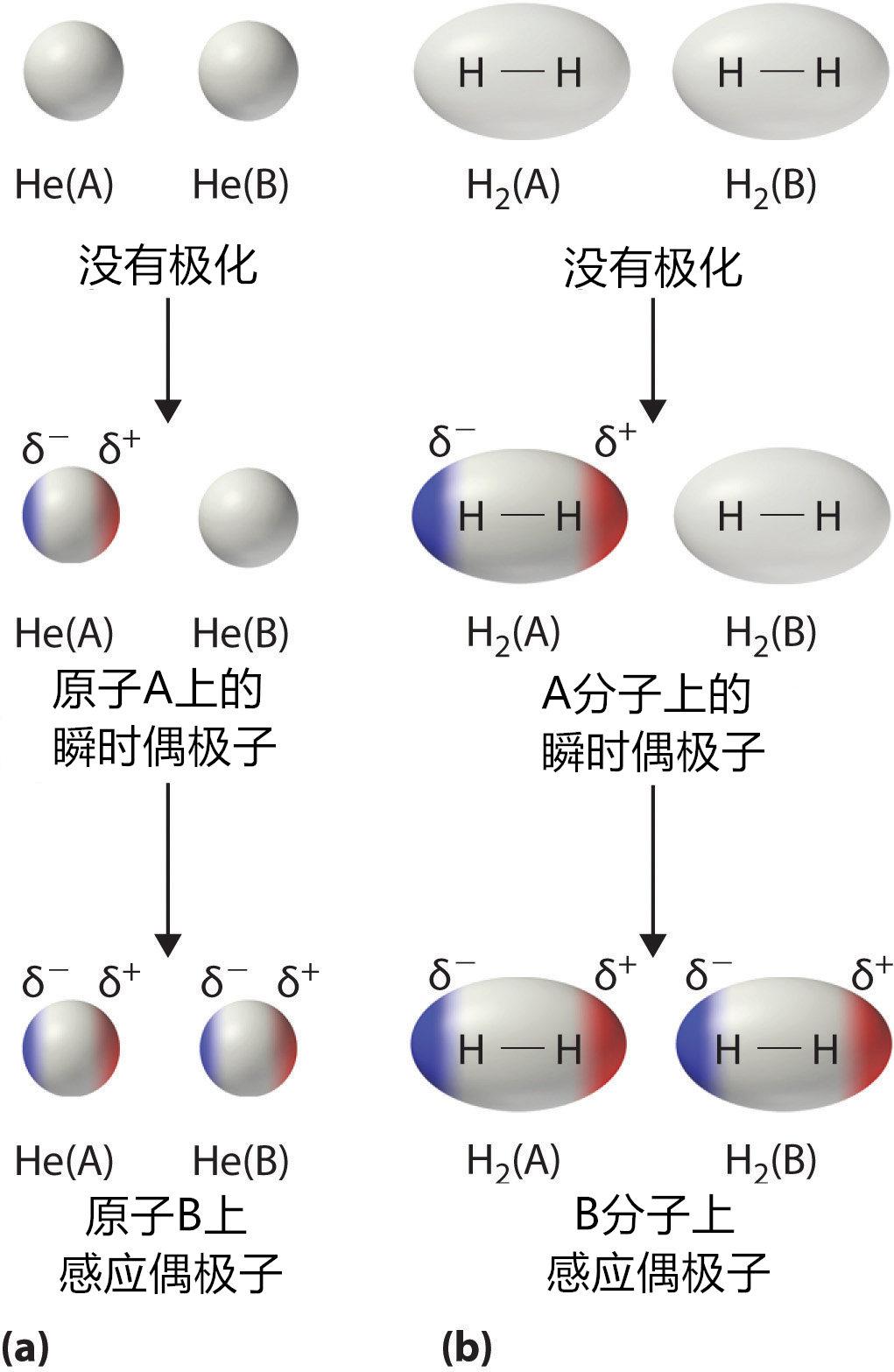
非極性分子感應偶極子產生倫敦力
水油不混溶的原因
通過前面的介紹,我們了解了:
水分子由于氫氧共價鍵是偶極子,同時兩個氫氧鍵之間存在夾角,所以水分子是偶極子。
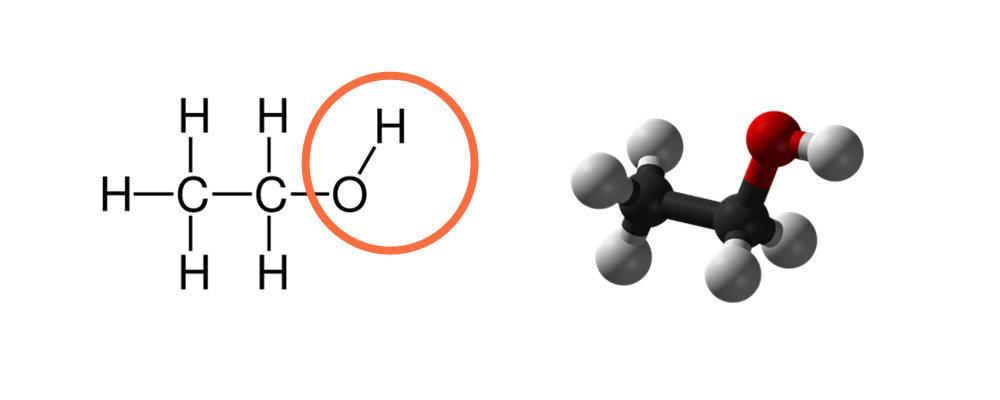
乙醇含有一個羥基(OH)因此它溶于水
水分子通過氫鍵互相連接形成大的水分子團,氫鍵比范德華力更強大,所以水分子會首先與相鄰的極性分子相互吸引并結合,從而形成表面張力。水可以接納其它同樣極性分子基團(例如OH、NH基團),但對非極性基團具有排斥性,它會拒絕其它分子特別是非極性分子加入,因此水顯示出對非極性物質(例如油)的排斥力。

將染色的油倒入水中,它們會很快分離
油大多含有CH鍵,CH鍵極性很弱(<0.4),因此它是疏水性的。水分子會首先與附近其它親水基團相結合形成氫鍵或離子鍵,而在水分子與油的分子之間僅存在微弱的感應電荷和范德華力,加之二者的密度不同,水與油不僅不會相互溶合,還會出現分層現象,我們可以很容易將其分離開來。

分液漏斗是實驗室中常見的油水分離裝置










