合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(二)
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(一)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(四)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(三)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(二)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(一)
> 弱堿三元采出液油水界面動態界面張力、強度、等特性研究
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(二)
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(一)
> 無人機噴霧作業下荔枝葉片上的表面張力、接觸角及霧滴沉積特性
(Delta-8)橄欖油兩性表面活性劑之間的協同作用和陰離子表面活性劑——結果和討論、結論、致謝!
來源:上海謂載 瀏覽 1635 次 發布時間:2021-12-29
結果和討論
制備與結構表征
橄欖油含有各種脂肪酸甘油酯。我們使用GC-MS色譜法測定其結構和含量,如表1所示。顯然,橄欖油最主要的成分是油酸甘油酯(74.48%),其次是棕櫚酸甘油酯(14.11%)和硬脂酸甘油酯(6.62%)。
表1。橄欖油的成分(wt%)。

通過FI-IR光譜(圖1)和正離子模式下的ESI-MS光譜(圖2和圖3)對源自橄欖油的羧基甜菜堿和磺基甜菜堿進行了表征。這些光譜特征的細節如下。在所有情況下,獲得的光譜與這些化合物的指定結構一致。羧基甜菜堿和磺基甜菜堿的產率分別為90.24%和73.28%。
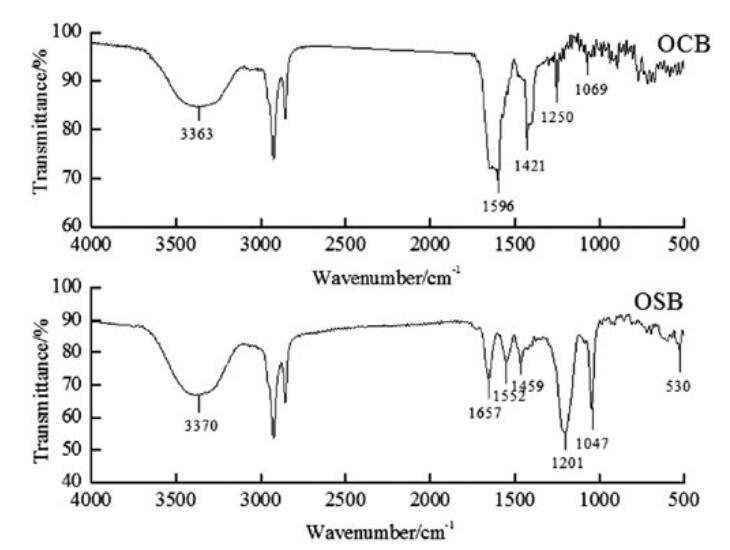
圖1。OCB和OSB的FT-IR光譜。
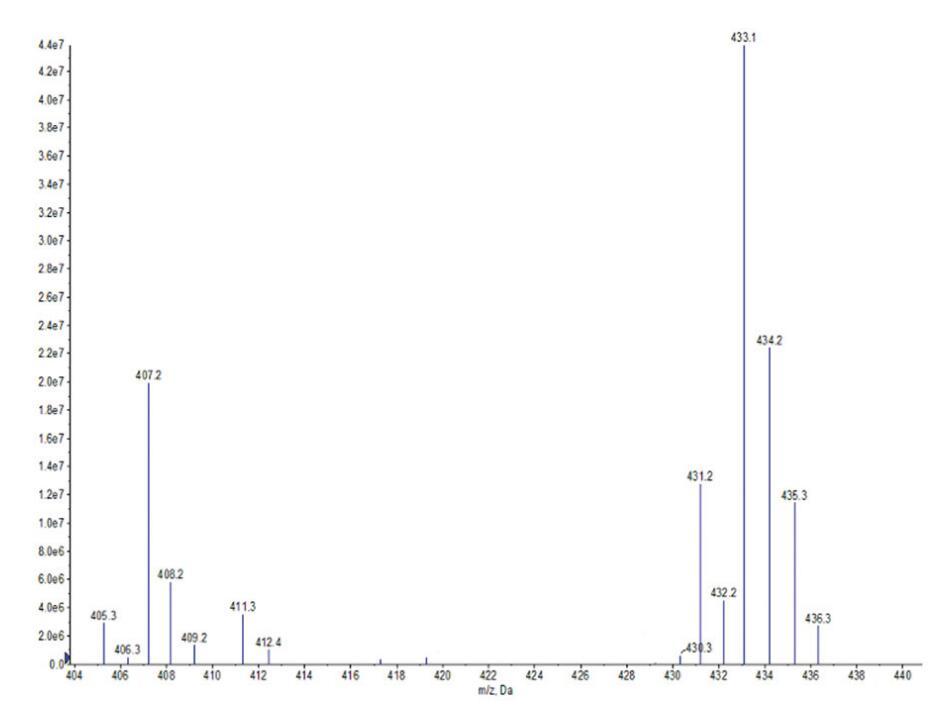
圖2。OCB的ESI-MS光譜。
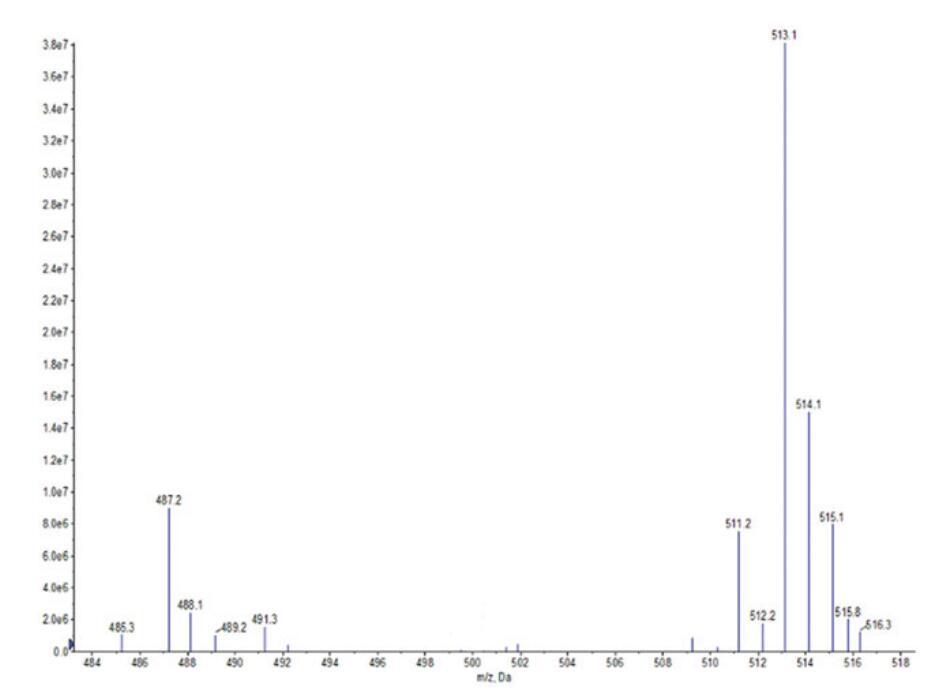
圖3。OSB的ESI-MS光譜。
OCB:IR:3363 cm-1(N-H)、1596 cm-1(C=O)、1250 cm-1(C-O)、1421 cm-1(酰胺鍵中的C-N)和1069 cm-1(季銨基中的C-N)。ESIMS:m/z=411.3,409.2分別歸因于由油酸甘油酯(C18:1)和亞油酸甘油酯(C18:2)與H+衍生的羧基甜菜堿;m/z=407.2、405.3、435.3、433.1、431.2,分別與來自棕櫚酸甘油酯(C16)、棕櫚油酸甘油酯(C16:1)、硬脂酸甘油酯(C18)、油酸甘油酯(C18:1)和亞油酸甘油酯(C18:2)的含Na+的羧基甜菜堿相匹配。
OSB:IR:3370 cm-1(N-H)、1657 cm-1(C=O)、1552 cm-1(N-H)、1459 cm-1(酰胺鍵中的C-N)、1047 cm-1(季銨基中的C-N)、1201 cm-1和530 cm-1(-SO3-)。ESI-MS:m/z=491.3,489.2分別歸因于由油酸甘油酯(C18:1)和亞油酸甘油酯(C18:2)與H+衍生的羧基甜菜堿;m/z=487.2、485.3、515.1、513.1、511.2分別與從棕櫚酸甘油酯(C16)、棕櫚烯酸(C16:1)、硬脂酸甘油酯(C18)、油酸甘油酯(C18:1)和亞油酸甘油酯(C18:2)中提取的含Na+的羧基甜菜堿相匹配。
等電點
表面活性劑溶液的pH值和電導率之間的關系如圖4所示。從橄欖油中提取的羧基甜菜堿和磺基甜菜堿表面活性劑顯示出廣泛的pI,是典型的兩性離子物種。如圖所示,制備產物的pI值為pH 4.0–10.0,其中分子存在于內部鹽化合物中。也就是說,這些新型表面活性劑在溶液中的pH值為4.0–10.0時為兩性(中性)。當pH值低于4.0或高于10.0時,它們表現出陽離子或陰離子行為,并顯示出高導電性。
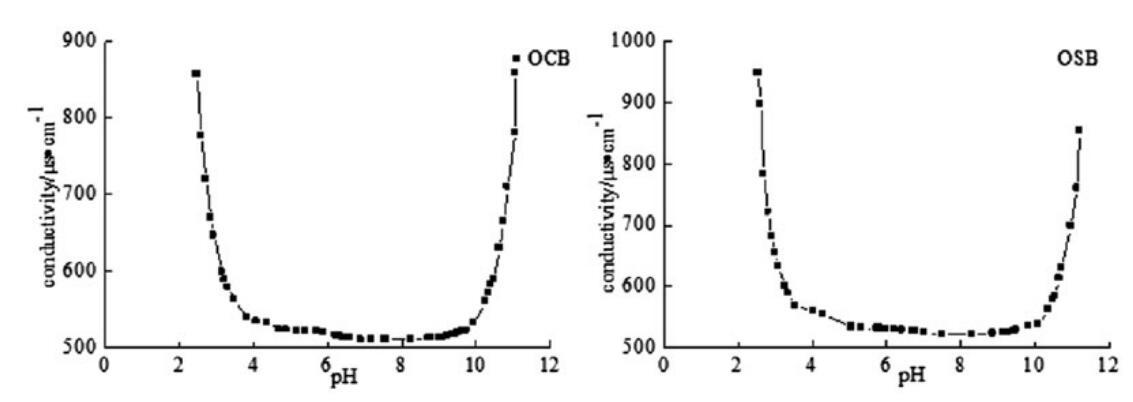
圖4。OCB和OSB在25℃時的pH電導率曲線。
本文研究了OCB和OSB的pI值,因為荷電表面活性劑之間的相互作用在協同作用(膠束相)和沉淀(如果系統處于正負電荷分子的高過飽和狀態,則在單體相)方面至關重要。為了討論合成的兩性表面活性劑在真正兩性狀態下的協同效應,我們決定在pH=7時進行以下實驗。
OCB/SDBS系統
在25℃下測量了不同摩爾比的OCB、SDBS和OCB/SDBS混合體系的表面張力。OCB/SDB(αOCB)的比率從0.2,0.4,0.6更改為0.8,總摩爾濃度固定為0.1 mol/L。圖5說明了濃度與表面張力之間的關系,表2總結了表面張力參數。
表2。OCB/SDS體系在25℃水溶液中不同摩爾分數(αOCB)的表面性質。
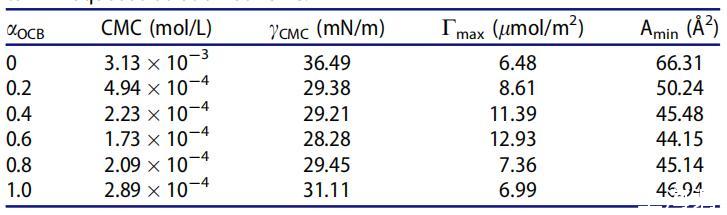
很明顯,二元表面活性劑混合物在混合范圍內的CMC和γCMC值低于單一表面活性劑,表明其在水溶液中具有更好的表面活性。隨著OCB摩爾分數的增加,CMC和γCMC值降低,在αOCB=0.6時,最低值為1.73*10-4 mol/L和28.28 mN/m。認為OCB的季銨陽離子部分與SDB的SO3-基團之間的強靜電吸引以及不同烴鏈之間的疏水作用導致混合膠束的形成并提高表面活性。[20]當αOCB大于0.6時,單個表面活性劑的自相互作用逐漸優先于膠束的形成。因此,OCB和SDB之間的靜電相互作用被降到次要位置,CMC和γCMC值正在增加。[21,22]
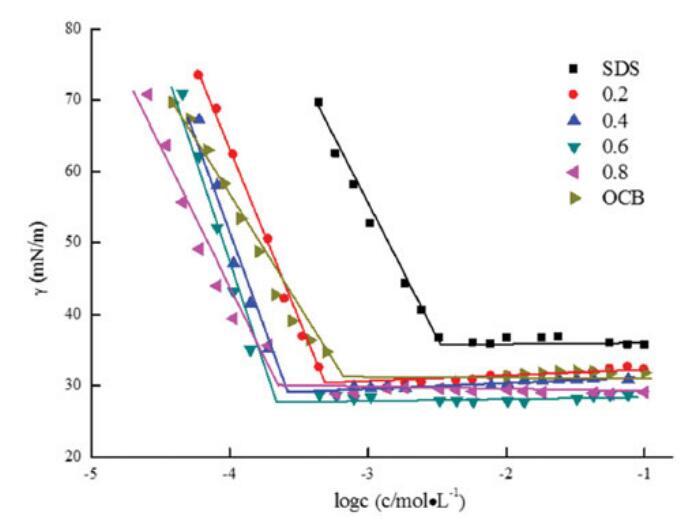
圖5。不同摩爾比下單獨OCB、SDS和混合OCB/SDS的表面張力與濃度對數的關系。
根據吉布斯吸附等溫線方程(方程1和2)[23]的近似形式計算最大表面過剩(Cmax)和最小表面積(Amin):
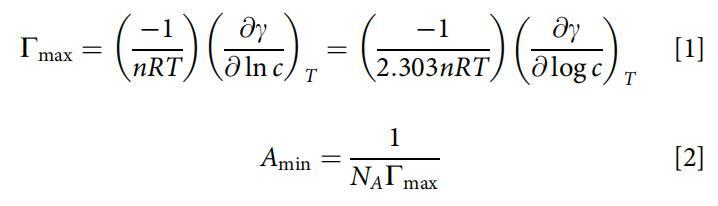
式中,c為表面活性劑水溶液的濃度,R=8.314 J/(mol·K),T為絕對溫度,n為兩性離子表面活性劑的1,( c/ ln c)為濃度接近CMC時表面張力等溫線的斜率,NA為阿伏伽德羅數。
Cmax和Amin表征了表面活性劑分子在氣液界面的堆積密度。Cmax值越大或Amin值越小意味著表面活性劑分子在空氣/水界面的堆積越緊密。[24]與單一化合物相比,在整個組成范圍內,OCB/SDBS混合物在空氣/水界面上的密度更大,表明聚集密度更高,更能降低水的表面張力。αOCB=0.6時,表面活性劑混合物的最大Cmax值和最小Amin值表明,在所有研究的摩爾分數內,OCB和SDB的吸引力最強。
從Clint方程(方程3)[25]中獲得了描述混合膠束形成理想狀態的理論理想混合CMCid:
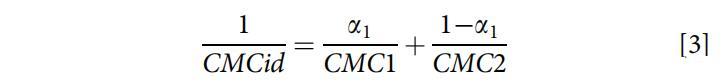
其中a1是總混合物中表面活性劑1(即OCB)的摩爾分數,CMC1和CMC2分別是純表面活性劑1(即OCB)和表面活性劑2(即SDB)的CMC。
理想CMC值如表3所示,并與圖6中的實驗CMC值一起繪制為OCB摩爾分數的函數。CMC與CMCid的偏差可以預測混合膠束的非理想性。結果表明,對于所研究的系統,實驗CMC值低于CMCid。由于結構的不同,這種偏差與二元體系的非理想混合行為一致,CMC的值低于相應的CMCid值可歸因于不同表面活性劑之間的吸引作用導致的混合膠束形成。
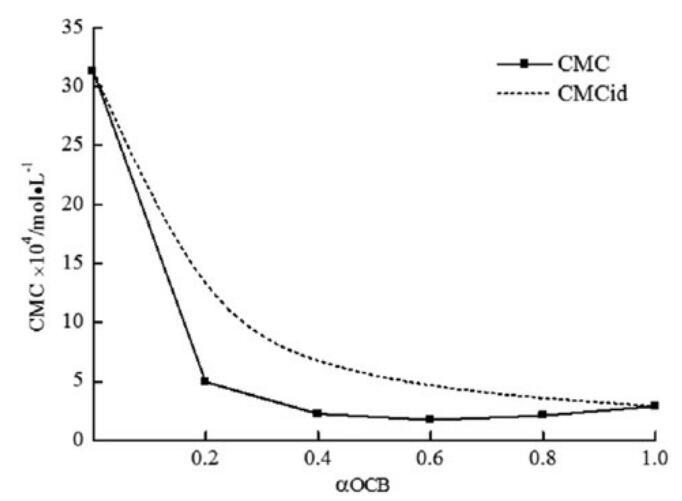
圖6。研究了實驗CMC、理想CMC與OCB摩爾分數的關系。
表3。25℃水溶液中OCB/SDS體系不同摩爾分數(αOCB)的非理想性及相互作用參數。

對于非理想的表面活性劑混合物,兩性表面活性劑OCB和陰離子表面活性劑SDB在水溶液中的分子相互作用強度通常由膠束相互作用參數bm來評估。根據正則解理論,bm可通過以下方程式(方程式4和5)[26]計算:
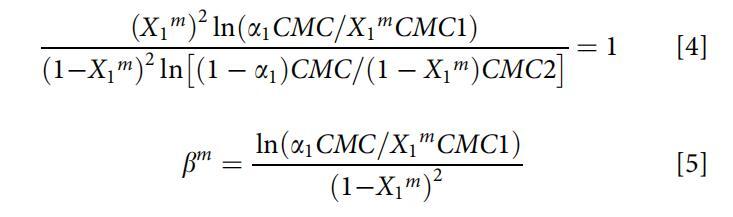
其中X1m是混合膠束中表面活性劑1(即OCB)的摩爾分數,CMC1、CMC2和CMC分別是表面活性劑1(即OCB)、表面活性劑2(即SDB)和混合物在摩爾分數a1(即OCB)處的臨界膠束濃度。
如表3所示,混合物在各摩爾分數下的bm值為負值,這意味著兩性狀態下的OCB與混合膠束中的SDB之間存在有吸引力的相互作用。bm的負值越大,膠束化過程中表面活性劑分子之間的相互作用越強烈。[27]bm值與αOCB成反比下降,并在αOCB=0.6時達到最小值,表明OCB/SDBS系統在整個組成范圍內的吸引力最強。此外,bm參數可被視為在給定二元系統中存在協同作用的指示。當混合膠束體系的CMC低于純表面活性劑的CMC時,混合膠束體系表現出協同作用,必須滿足兩個條件:(1)bm必須為負;(2)jbmj>jln(CMC1/CMC2)j。從表3中提供的數據可以得出結論,本研究中pH=7時表面活性劑混合物的所有摩爾比均滿足所用標準。因此,在所研究的OCB/SDBS混合物中存在混合膠束化的協同作用。
值得一提的是,在bm負值較大的系統中,獲得的平衡表面活性劑組成與理想線(X1m>αOCB)存在正偏差。由于不同表面活性劑分子之間的分子間內聚力,它可以預測規則溶液理論建模線以擬合實驗CMC數據。[27]
OSB/SDBS系統
在25℃下測量了不同摩爾比的單獨OSB、SDBS和OSB/SDBS混合體系的表面張力。OSB/SDB(αOSB)的比率從0.2,0.4,0.6更改為0.8,總摩爾濃度固定為0.1 mol/L。圖7說明了濃度與表面張力之間的關系,表4總結了表面張力參數。
表4。25℃水溶液中不同摩爾分數(αOSB)OSB/SDS體系的表面性質。
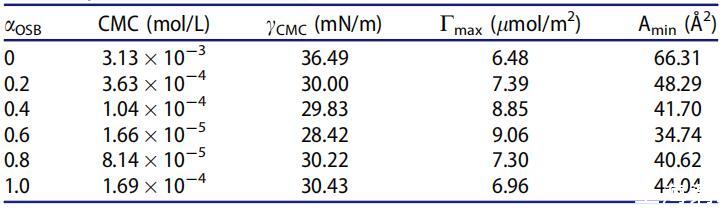
如表4所示,在混合范圍內,OSB/SDBS系統的CMC和γCMC值低于單個表面活性劑的CMC和γCMC值,并且在αOSB=0.6時顯示出最低值1.66*10-5 mol/L和28.42 mN/m。它起源于兩種不同的表面活性劑分子之間的強相互作用,兩種不同的表面活性劑分子具有相反的電荷頭基團以及它們在不同烴鏈之間的疏水相互作用。然而,當αOSB>0.6且CMC值和γCMC增加時,單一表面活性劑的自相互作用基本上占主導地位。
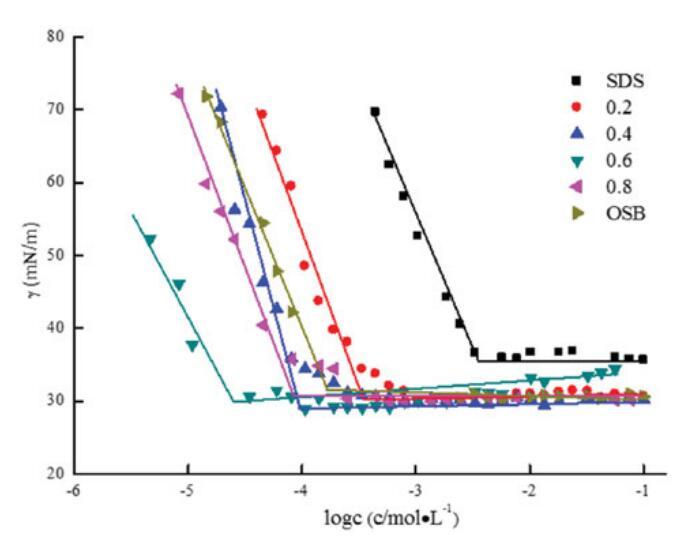
圖7。不同摩爾比下單個OSB、SDS和混合OSB/SDS的表面張力與濃度對數的關系。
表4中列出的Cmax和Amin值進一步證明,兩性離子/陰離子表面活性劑混合體系比各自的純表面活性劑具有更出色的表面活性。與純表面活性劑相比,Cmax值越大,Amin值越小,表明二元表面活性劑體系的結合越好。αOCB=0.6時,混合OSB/SDB的最大Cmax值和最小Amin值可歸因于OSB和SDB在總摩爾分數內最強的吸引相互作用。
將CMC的理想值與表中的摩爾分數a和摩爾分數B繪制成表格。在OSB/SDBS混合物的情況下,在整個摩爾分數范圍內,較低的實驗CMC值比CMCid值可以證明由于結構差異導致的非理想混合行為。骨料中的非理想混合效應導致協同作用,并導致CMC低于僅基于未混合表面活性劑性質的預期值。
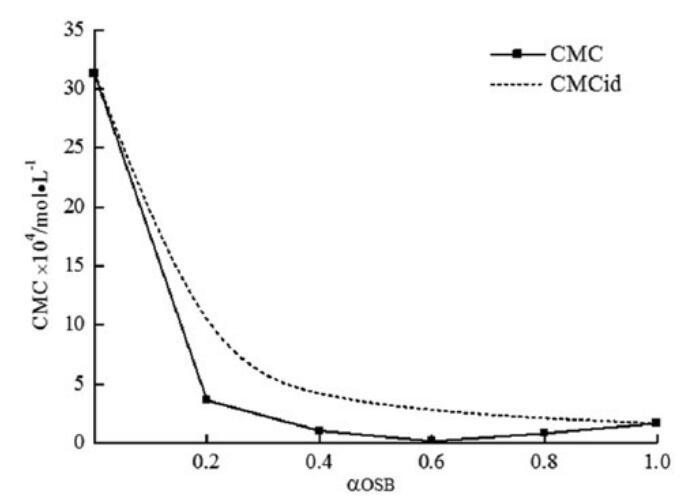
圖8。研究了實驗CMC、理想CMC與OSB摩爾分數的關系。
表5。25℃水溶液中不同摩爾分數(αOSB)OSB/SDS體系的非理想性及相互作用參數。
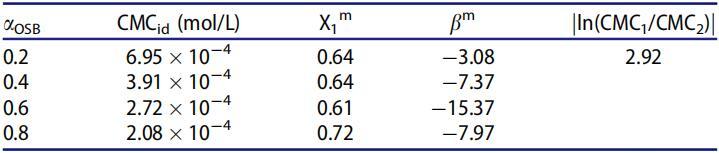
表5顯示所有混合物的bm值均為負值,這意味著混合膠束中OSB和SDB之間存在有吸引力的相互作用,很明顯jbmj值高于jln(CMC1/CMC2)j值。因此,OSB/SDBS系統在OSB的所有摩爾分數下表現出明顯的協同作用,并且在αOSB=0.6時表現出最顯著的協同作用。
在bm負值較大的系統中,獲得的平衡表面活性劑組成與理想線(X1m>αOSB)存在正偏差。由于不同表面活性劑分子之間的分子間內聚力,它可以預測規則溶液理論建模線以擬合實驗CMC數據。
此外,我們還比較了OCB/SDBS和OSB/SDBS系統的計算bm值。由于在二元表面活性劑體系中,bm的較大負值有利于混合膠束的形成,一般認為OSB/SDBS混合物中的協同作用程度大于OCB/SDBS混合物中的協同作用程度。
無機鹽對兩性離子/陰離子表面活性劑混合體系表面活性的影響
通過表面張力測量實驗測定了無機鹽(NaCl和MgCl2)對混合OCB/SDBS和OSB/SDBS系統中表面活性的影響,如圖9和圖10所示。每個混合體系的表面活性劑總濃度為0.1 mol/L,兩個體系的摩爾分數分別固定為αOCB=0.6和αOSB=0.6,其中混合物表現出最強的協同作用。無機鹽的濃度從0 wt%改變到0.2 wt%。
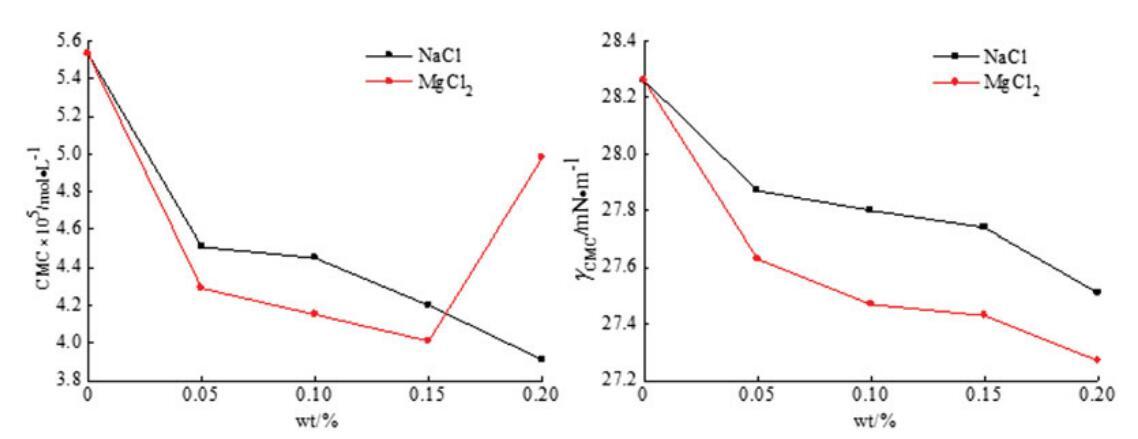
圖9。無機鹽(NaCl和MgCl2)對OCB/SDS體系中表面活性的影響。
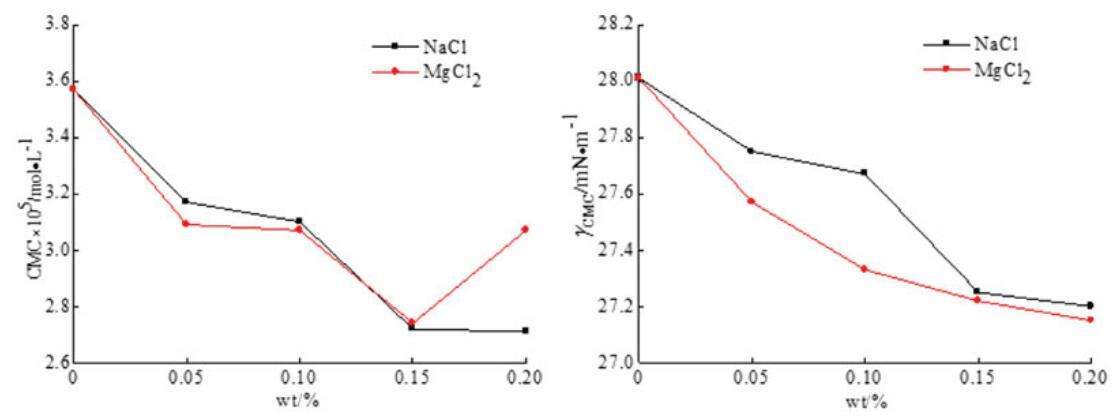
圖10。無機鹽(NaCl和MgCl2)對OSB/SDS系統中表面活性的影響。
從圖9和圖10可以看出,二元表面活性劑混合物的CMC值通常隨著無機鹽濃度的增加而降低,并且在添加無機鹽后,兩個混合體系的γCMC值降低。結果表明,在兩性離子/陰離子表面活性劑混合體系中,無機鹽的應用可以減少帶電膠束之間的排斥作用,促進混合膠束的形成。因此,無機鹽有助于促進膠束的生長和增強表面活性。此外,與單價金屬離子NaCl相比,含有二價金屬離子MgCl2的無機鹽具有稍好的表面活性效果。二價金屬離子比一價金屬離子帶更多電荷,更能接近混合膠束,減少二元體系中帶電膠束之間的排斥。[28]因此,MgCl2在增強混合表面活性劑體系的表面活性方面更有效。然而,隨著MgCl2濃度的進一步增加,CMC值略有上升。這可能是因為濃度過高的金屬離子會在水溶液中的帶電膠束之間引發松散的靜電吸附,并導致表面活性降低。
結論
研究了橄欖油兩性表面活性劑與陰離子表面活性劑(OCB/SDBS和OSB/SDBS)的表面性質及其協同作用。我們得出結論,兩性離子表面活性劑和陰離子表面活性劑之間的強吸引相互作用導致空氣/水界面上的分子排列更緊密,并可歸因于混合膠束的形成。因此,OCB/SDBS和OSB/SDBS混合物在所有研究摩爾分數下的表面活性均高于各自的組分。根據CMC與CMCid的偏差,發現混合甜菜堿/sdb在整個摩爾分數內存在明顯的非理想混合行為。對于非理想表面活性劑混合物,bm值為負值,且在每個摩爾分數下jbmj>jln(CMC1/CMC2)j。這些條件表明OCB/SDBS和OSB/SDBS系統在整個組成范圍內存在明顯的協同作用。此外,根據最小bm值確定了最強吸引相互作用的最佳組成,αOCB=0.6和αOSB=0.6。無機鹽NaCl和MgCl2可提高混合表面活性劑溶液的表面活性,且CMC和γCMC值一般隨無機鹽含量的增加而降低。此外,MgCl2對混合物的表面能力效應略好于NaCl,因為二價金屬離子更能減少二元體系中帶電膠束之間的排斥作用。
披露聲明
作者沒有報告潛在的利益沖突。
基金
感謝國家自然科學基金(21676003)、北京市科技計劃(Z17110013131715)、中國國家重點研究項目(2017YFB0308701)、中國北京市教育委員會科技計劃重點項目(KZ2015100110)科技成果轉化促進計劃項目(PXM2016_014213_000028)。










