合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 強紫外線輻射對減縮劑抑制水泥石干縮變形效果研究(一)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(四)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(三)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(二)
> 無機粒子對TPAE界面張力、發泡、抗收縮行為的影響(一)
> 弱堿三元采出液油水界面動態界面張力、強度、等特性研究
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(二)
> 植保無人機噴頭和噴霧助劑對藥液表面張力、霧滴密度、覆蓋率的影響(一)
> 無人機噴霧作業下荔枝葉片上的表面張力、接觸角及霧滴沉積特性
> 不同界面張力-潤濕性組合的滲吸液體系對于化學滲吸效果的影響規律
酯功能化的雙子表面活性劑與血紅蛋白的結合——結果和討論
來源:上海謂載 瀏覽 1270 次 發布時間:2021-11-15
三、結果和討論
3.1. 表面張力測量
表面張力測量用于研究 關于 16-E2-16/Hb 相互作用的定性信息 空氣/水界面。 圖 1 顯示了 16-E2-16 分布的表面張力與對數濃度在不存在和 在不同溫度下存在 Hb (5 μM)。 斷點 表面張力與表面活性劑濃度對數的關系 不同溫度下純表面活性劑的文件對應 到相應溫度下表面活性劑的 cmc。 這 16-E2-16/Hb體系的表面張力曲線呈現兩個斷裂 點,第一個斷點對應臨界聚合 濃度(cac)代表表面活性劑的開始 蛋白質結合而作為第二個斷點對應于 在 Hb 存在下 16-E2-16 的 cmc。 16-E2-16 的 cmc 在不同溫度下不存在和存在 Hb 的情況下 列在表 1 中。從這些值可以看出,16-E2-16 的 cmc 隨著 Hb 的存在和溫度升高而增加。 在 Hb 存在下 cmc 的增加證實了 16-E2-16/Hb 復合物的形成,在此期間一些單體 與 Hb 結合,因此無法形成膠束 進而導致膠束化延遲 [54]。 表1還 表明 cmc 值隨溫度升高而增加 這意味著疏水力的參與,它們是 溫度依賴,在 cmc 的蛋白質表面活性劑相互作用中。 這可以歸因于 16-E2-的溶解度增加 16 單體隨溫度變化而抑制膠束化。 此外,較高的溫度有利于熱運動,這會導致 更多的分子與 Hb 結合。 但是,cac 保持不變 在所有溫度下。 因此,我們可以認為 16-E2-16 與 Hb 結合 通過 cac 附近的靜電相互作用,因為靜電 相互作用不受溫度影響。 此后,作為 表面活性劑濃度增加,蛋白質通過疏水力與表面活性劑相互作用。 下表面張力值 Hb-16-E2-16系統比對應的16-E2-16系統是 由于 Hb 的高表面活性。
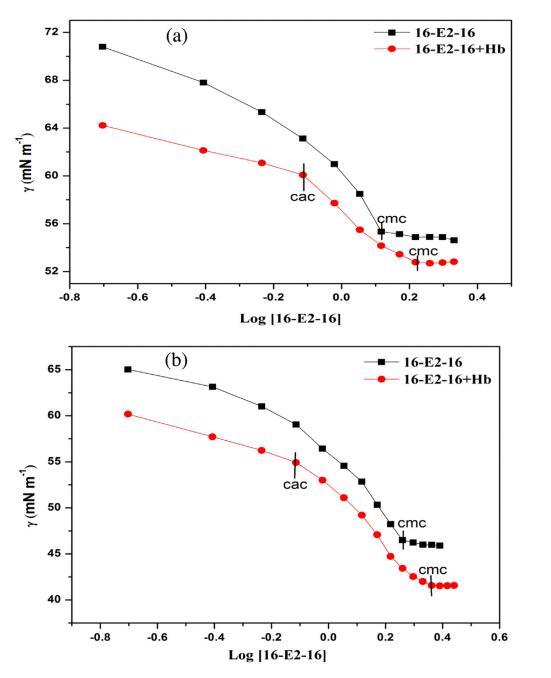
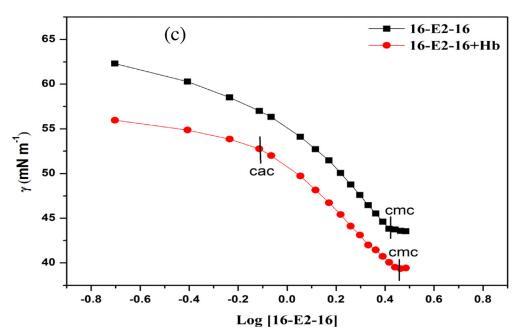
圖 1. 16-E2-16/Hb 在不同溫度下的表面張力。 (a) 298.15K (b) 308.15K (c) 318.15K。 [Hb] = 5 μM。
3.1.1. 界面參數
最大表面過量 (∫max) 表示為每單位面積界面處的表面活性劑分子濃度。 表面張力數據用于計算表面過量 應用吉布斯吸附等溫線的濃度 (∫max) 方程:

其中 γ 是表面活性劑濃度 C 下的平衡表面張力 (mNm?1),n 是每分子的粒子數 表面活性劑。 由于表面活性劑的解離導致三種物質的形成,公式 1111 表示在低于 cmc 的恒定溫度下 γ 與 log[16-E2-16] 之間的曲線斜率。 ∫max 值允許計算 每個分子 Amin 的最小表面積(以 nm2 為單位) 方程:

表格1 不同溫度下 Hb 不存在和存在時 16-E2-16 的 cmc、∫max 和 Amin
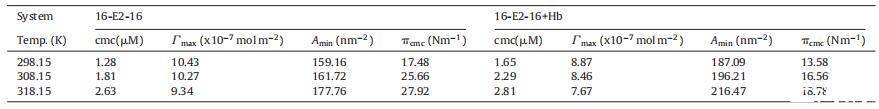
其中 NA 是阿伏伽德羅數。 為 ∫max 獲得的數據 和 Amin 列于表 1。發現 ∫max 值為 16- E2-16 隨溫度升高而降低,表明 系統涉及靜電和疏水相互作用[55]。 Amin 值隨溫度升高而增加 正如分子運動增加所預期的那樣 [56]。 ?cmc ,其定義為表面活性劑降低表面張力的有效性,測量為 cmc 處的表面壓力 [57],和 從關系計算:

其中γ o 和γ cmc 是指溶劑體系的表面張力 (水/水 + Hb) 和 cmc 值下溶液的表面張力。
3.1.2. 熱力學參數
離子表面活性劑在水溶液中膠束化的熱力學參數可以借助 以下方程使用質量作用模型膠束化 [58]

其中αG0m、αH0m和αS0m是自由能、焓的變化 和膠束化熵,Xcmc 是 cmc 處的摩爾分數。 這 從方程 (6-8) 獲得的值顯示在表 2 中。
表 2 膠束化的自由能 (αG0m)、熵 (αS0m) 和焓 (αH0m) 的變化以及自由能 (αG0) 的變化 ad) 不存在和存在時 16-E2-16 的吸附 不同溫度下的 Hb。
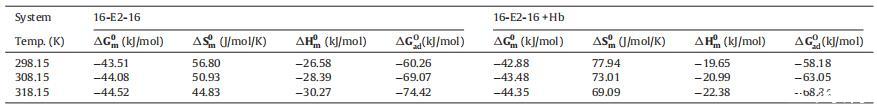
這 αG0m 在所有溫度下的負值表明容易 在所研究的條件下形成膠束。 此外, αG0m 的負值隨溫度升高而增大 這表明16-E2-16分子在高溫下脫水是膠束形成的主要因素。 這 膠束化 αH0m 的負值證實了放熱 過程的性質。 獲得的 αS0m 值都是正的,表明系統在轉換后增加了隨機性 離子表面活性劑分子變成膠束。 換句話說,我們可以 說對表面活性劑的運動有較小的阻礙 分子存在于膠束中時。
標準吸附自由能,αG0 這個系統的廣告是 使用關系計算:

αG0 的值 由此獲得的 ad 列于表 2 中。 吸附熱力學參數αG0 廣告價值全是 負且比 αG0m 更負,表明界面處的吸附與自由能的降低有關 系統的。 這可能是由于空間因子對 對膠束化的抑制作用大于對吸附作用的影響。
3.2. 紫外-可見研究
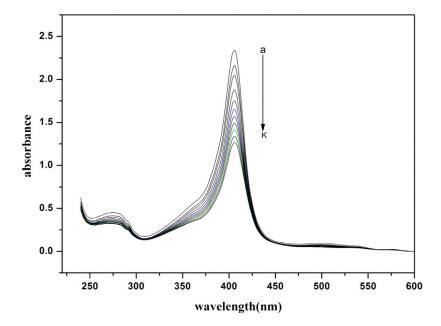
Hb 在其吸收光譜中顯示三個不同的峰。 這些 是; Trp 和 Tyr 殘基的苯基(273 nm), -樂隊 (360 nm) 和卟啉-索雷帶 (404 nm,強烈允許 - * 電子躍遷)[59,60]。 這個樂隊起源于 血紅素基團,嵌入由 蛋白質的骨架通過適當的折疊[61,62]。 變化 soret 吸收帶的位置和強度 提供有關蛋白質在綴合過程中可能發生解折疊和變性的信息 [59,60,62,63]。 圖 2 顯示了 不存在和存在各種濃度的 Hb 的吸光度 16-E2-16。 添加 16-E2-16 顯示出顯著的 Soret 帶強度的光譜變化,但峰值位置保持不變。 16-E2-16 降低強度 soret 帶暗示 16-E2-16 可以訪問血紅素組 并直接參與擾亂結構和暴露 水介質中的血紅素基團 [61]。 換句話說我們 可以說,由于蛋白質的血紅素基團與 16-E2-16 的某種相互作用,Hb 經歷了擾動。 血紅蛋白是 由于工作 pH 值 (7.4) 較大,因此帶輕微負電荷 比 Hb 的 pI (6.86) 和在這種情況下陽離子的相互作用 表面活性劑與蛋白質同時具有靜電和疏水性 [64] 然而,這與表面張力結果非常吻合,van 德瓦爾斯力不容忽視。
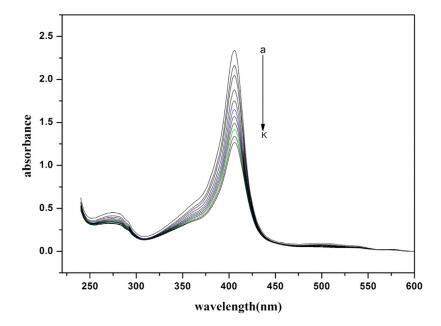
圖 2. 不存在和存在 16-E2-16 時 Hb (5 μM) 的紫外-可見光譜。 這 16-E2-16 (am) 的濃度為 0, 0.39, 0.76, 1.13, 1.48, 1.81, 2.14, 2.45, 2.75, 3.05 和 3.33 μM。
3.3. 熒光光譜研究
Hb 的熒光主要是由于色氨酸和酪氨酸殘基的存在。 圖 3 顯示了熒光光譜 Hb 不存在和存在 16-E2-16。 每個 α 和 ˇ 鏈中有 3 個色氨酸(α214Trp、β215Trp、β217Trp)。 根據 Rodgers 的說法,[65] Hb 的內部熒光主要是 來源于 β237Trp。 由于 Trp 和血紅素都位于 在 Hb 的疏水腔中,有效的能量轉移來自 Trp 到血紅素顯著淬滅蛋白質熒光 [66] 因此,水中 Hb 的熒光強度非常低。 當用不同量滴定固定量的 Hb 時 在 16-E2-16 中,Hb 熒光強度的增加是 觀察到(圖 3)表明表面活性劑分子滲透 Hb 的疏水腔并暴露血紅素,從而 用血紅素抑制 Trp 猝滅,從而抑制熒光 Hb 強度明顯增加。 最初,熒光 強度迅速增加,但當 16-E2-16 的濃度 超過它的cmc,熒光強度緩慢增加 此后。 對這一觀察結果的合理解釋是 疏水腔中疏水血紅素的溶解 表面活性劑膠束增加血紅素之間的距離 和 trp 并以這種方式抑制了 Trp 之間的能量轉移 和血紅素。
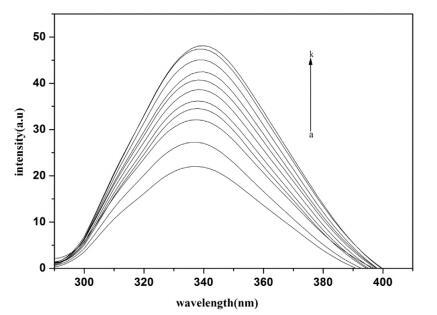
圖 3. 不存在和存在 16-E2-16 時 Hb (5 μM) 的熒光光譜。 這 16-E2-16 (ak) 的濃度為 0, 0.39, 0.76, 1.13, 1.48, 1.81, 2.14, 2.45, 2.75, 3.05 和 3.33 μM。
圖 4 為 Hb 的同步熒光光譜 16-E2-16 在水體系中,μ = 20 nm(圖 4a)和 γ? = 80 nm(圖 4b)。 當 μ= 20 nm 時,特征信息 關于Tyr,當γμ= 80 nm 時,獲得關于Trp 的特征信息[67]。 從圖中可以看出 Tyr 和 Trp 的熒光強度增加,熒光發射波長幾乎保持不變 添加 16-E2-16。 從圖 4(a 和 b)可以看出,Trp 的熒光強度增加大于 Tyr。 因此,Trp 熒光可以代表 Hb 熒光 16-E2-16/H2O 系統。

圖 4. Hb (5 μM) 的同步熒光光譜。 (a) α∫= 20 nm (b) ? = 80 納米。 16-E2-16(ah)的濃度分別為0、0.39、0.76、1.13、1.48、1.81、 2.14 和 2.45,μM。
3.4. 圓二色性
進行CD以進一步確認構象變化 由 16-E2-16 引起的 Hb,從而允許進一步評估 Hb 和 16-E2-16 之間的相互作用。 圖 5 顯示了 不存在和存在 16-E2-16 時 Hb 的 CD 光譜。 光盤 Hb 的光譜在 208 nm 和 222 nm 處顯示兩個負最小值, 蛋白質α-螺旋結構的特征。 16-E2-16 光學不活動不顯示任何信號。 在場 在 16-E2-16 中,Hb 的負橢圓度降低,表明 可能形成 Hb/16-E2-16 復合物 [68]。 α-螺旋 計算了 Hb 及其與 16-E2-16 (2 μM) 復合物的百分比,發現分別為 53% 和 47%。 進一步降低 在更高濃度的 16-E2-16 (2.5 μM) 存在下達到 44% 表明 Hb 的 α-螺旋含量明顯降低。 因此, CD 結果表明存在 16-E2-16 變化 Hb 的二級結構與我們的 計算結果。
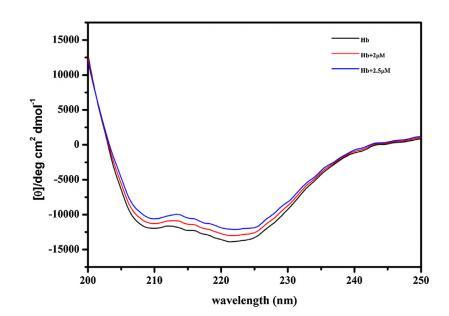
圖 5. 不存在和存在 16-E2-16 時 Hb (5 μM) 的 CD 光譜。
3.5. 分子對接
Hb 中的 α 和 β 鏈具有相似的結構折疊, 由七個連續的α-螺旋和兩條鏈組成 包含由螺旋 4 和 5 包圍的間隙結合袋,而空腔的底部由 C 端部分形成 螺旋 6 和螺旋 7 的 N 端片段 [69]。 16-E2-16為主 Hb 與中央空腔、α1 和 β2 鏈結合(圖 6A)。 這 該結合位點上的氨基酸殘基包括 Thr39, α1 中的 Tyr42、Phe43、Pro44、His45、His58、His87、Leu91、Val93、Asn97 鏈和 Leu31、Arg40、Phe41、Phe42、His63、Val67、Ala70、Phe71、 His92, Leu96, His 97, Val98, Asn102, Phe103, Leu106, Leu141 in β2 鏈圖 6B。 有超過 20 個氨基酸殘基位于 16-E2-16 的站點,這意味著它們之間的強相互作用 16-E2-16 和 Hb [70]。 疏水性和靜電力作用 在 16-E2-16 與 Hb 的結合中起重要作用,這個結果是 與我們的實驗結果一致。 然而,范德瓦爾斯 力量不容忽視。 已觀察到一個氫鍵 在 16-E2-16/Hb 相互作用中的 16-E2-O 原子 具有 β2 鏈 ARG40 的 16 個分子(圖 6C)。 的形成 氫鍵穩定 16-E2-16/Hb 復合物。 的類型 相互作用和參與相互作用的氨基酸殘基 以表格形式顯示(表 3)。
表3 結合能、結合常數和活性位點殘基及其與配體的相互作用類型。
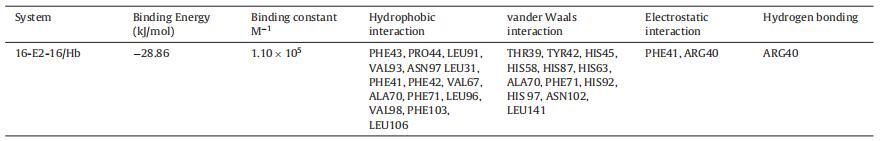
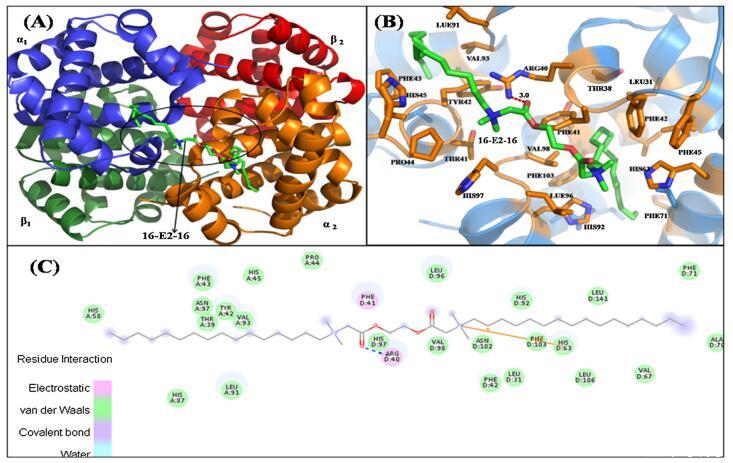
圖 6. 具有 16-E2-16 的 Hb 結構示意圖。 (A) Hb-16-E2-16 的結構。 Hb 的亞單位用不同的顏色表示。 配體 16-E2-16 是 以棍子為代表。 (B) 距停靠的 16-E2-16(綠色)5? 范圍內 Hb 的周圍氨基酸殘基(橙色)。 (C) Hb/16-E2-16 相互作用的二維表示。 (為了 對圖例中顏色參考的解釋,讀者可參考本文的網絡版本。)
3.6. 分子動力學模擬
進一步研究16-E2-16的結構穩定性影響 結合Hb,采用分子動力學模擬。 我們分析了兩者的動態結構特性,例如均方根偏差 (RMSD) 和回轉半徑 (Rg)。 未綁定和 16-E2-16 有界 Hb 使用從獲得的軌跡 MD模擬。
為了探索 Hb 的穩定性和動力學特性 綁定后,未綁定和16-E2-16有界的MD模擬 Hb 是針對 20000 ps 的模擬時間尺度進行的。 圖 7(A) 顯示未結合和 16-E2-16 的 RMSD 值 有界 Hb 復合物從 0 ps 突然增加到 6000 ps 并且 此后兩個系統都達到平衡相并獲得 在整個仿真過程中,RMSD 值穩定,波動小。 未結合和 16-E2-16 有界 Hb 的 RMSD 值 分別為 0.38 ± 0.02 和 0.34 ± 0.01 nm,在 最后 10000 ps 軌跡。 因此,很明顯 16-E2-的 RMSD 值 16 有界 Hb 小于未結合 Hb。 這一結果表明 16-結合后的結構變化和復合物形成 E2-16 與 Hb 顯示出與我們的 UV-vis 的良好一致性 結果 [71]。
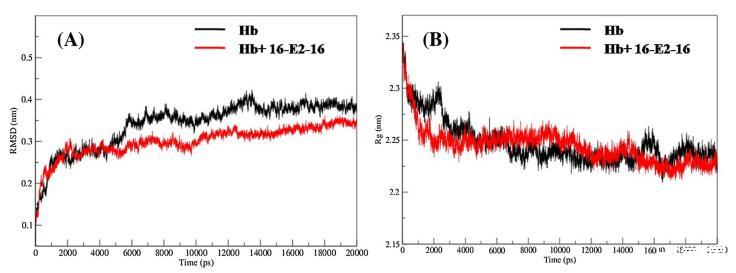
圖 7. (A) RMSD 和 (B) Rg 隨未結合和 16-E2-16 有界 Hb 的模擬時間的變化。
Rg 值給出了整體結構的精細測量 Hb 的維度。 未結合和 16-E2-16 有界 Hb 在模擬 20000 ps 時間尺度上計算的 Rg 值 如圖7(B)所示。 該圖清楚地表明,最初未結合的和 16-E2-16 有界的 Hb 具有相同的 Rg 值 (2.34 nm) 并在 4000 ps 左右達到平衡,此后為 Rg 值在整個模擬期間保持穩定,波動很小。 該 Rg 值與報告的 Hb 的 Rg 值相似 (2.37 ± 0.05 nm) 通過中子散射技術測量 水溶液[72-75],因此表明模擬結果的準確性。 達到平衡后,未結合的 Rg 值和 發現 16-E2-16 有界 Hb 為 2.22 ± 0.02 和 2.21 ± 0.02 分別在整個模擬過程中波動很小。 從 6000 到 12000 ps,16-E2-16 結合 Hb 的 Rg 值有 略有增加,而從 14000 到 20000 ps,Rg 值減少 關于未結合的 Hb。 Rg 值的這種變化表明 16- E2-16 在 Hb 中引起了一點構象變化 [68],這 與實驗結果相似,與CD吻合良好 結果。










